| |
UVOD
Glatki mišići GIT-a su inervisani holinergičkim ekscitatornim
nervima, nitrergičkim inhibitornim nervima i neadrenergičkim
neholinergičkim (NANC) nervima [1]. NO je poznat kao medijator kojeg
oslobađa široko rasprostranjena mreža neuro-na sa prevashodno NANC
aktivnošću [2].
Endogeni NO se sintetiše iz L-arginina pod dejs-tvom enzima azot
monoksid sintetaze (NOS), pri čemu se oslobađa L-citrulin [3]. NOS iz
endoteli-jalnih ćelija (eNOS) i neurona (nNOS) su konstitu-tivno
eksprimirani enzimi, čija je aktivnost stimuli-sana povećanjem
koncentracije ekstraćelijskog kal-cijuma (Ca2+). Inducibilna NOS (iNOS)
je Ca2+-nezavisna, i aktivira se citokinima uključenim u procese
inflamacije (npr. u Gram negativnom endotoksičnom šoku) [4, 5, 6].
NO je nosilac reaktivnog elektronskog para, koji podleže oksidativnom
procesu, pri čemu se formira-ju mnogo aktivniji intermedijerni produkti,
kao što je npr. peroksinitrit (ONOO-). ONOO- je sposoban za toksičnu nitrozilaciju i/ili nitraciju nekih aminokiselinskih ostataka proteina,
kao što su tirozin i cistein [7]. NO, za razliku od drugih
intraćelijskih molekula, slobodno difunduje kroz ćelijsku mem-branu i
može uticati na brojne biosintetske, metaboličke i signalne procese kao
i na procese membranskog transporta [8]. NO ima varijabilni poluživot u
biološkom miljeu, što zavisi od njegove koncentracije, kao i od
koncentracije kiseonika i drugih sup-stanci [8, 9].
U objašnjenju molekularnih mehanizama nastanka mnogih fizioloških i
patofizioloških stanja, mehanizmi regulacije, kao i sama uloga NOS-a
imaju poseban značaj, uključujući posebno ulogu NO-a u apoptozi [10],
angiogenezi [11], peristaltici [12], reprodukciji [13], zaceljenju
površinskih rana [14], kontrakciji poprečno prugastih mišića [15],
oslobađanju Ca2+ iz sarkoplazmatičnog retikuluma [16], metabolizmu
glukoze [17], aktivaciji mastocita [18], funkciji srca [19, 20] i
vaskularnoj relaksaciji [20]. U GIT-u, NO ima važnu ulogu u motilitetu,
posebno u nervno posredovanim relaksacijama pilorusa, jejunuma, kolona i
unutrašnjeg analnog sfinktera [21]. Takođe, NO deluje na unutar- i ekstraćelijske
signalne molekule u glatkim mišićima GIT-a i važan je medijator u
brojnim fiziološkim i inflamatornim procesima [4, 5, 6, 22].
LOKALIZACIJA NOS U GI TRAKTU
Enzim NOS je lokalizovan imunocitohemijskom metodom, primenom
specifičnih antitela koja prepoznaju nNOS u GIT-u pacova [23],
zamorčića [24], psa [25] i ljudi [26]. U longitudinalnim miši-ćima sa
mijenteričkim pleksusom ileuma pacova, potvrđeno je prisustvo nNOS [27],
ali ne i iNOS i eNOS, tako da se smatra da je nNOS odgovorna za sintezu
nitrergičkog transmitera u ovom tkivu [28]. U pojedinim delovima GIT-a,
u glatkim mišićnim ćelijama, detektovana je specifična forma konstitutivne
NOS [29]. mRNA nNOS u glatkim mišićnim ćelijama u GIT-u [30] se
razlikuje od mRNA NOS u glatkim mišićnim ćelijama u krvnim sudovima u
kojima je nađena iNOS [31].
MOLEKULARNI MEHANIZMI DELOVANJA NO U GIT-U
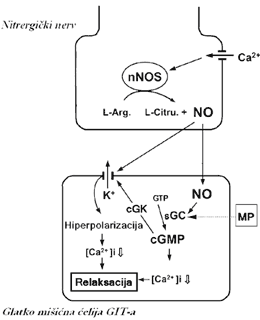
Tokom trajanja intestinalne peristaltike mijenterički neuroni
stvaraju akcioni potencijal, pri čemu rezultujući influks Ca2+ aktivira
kalmodulin, koji podstiče stimulaciju nNOS-a [32]. NO se oslobađa iz
presinaptičkih nervnih završetaka i u mijenteričkim glatkim mišićima
aktivira solubilnu formu guanilil ciklaze (sGC), da sintetiše ciklični
guanozin mono-fosfat (cGMP) [33, 34]. Akumulacija cGMP-a u glatkim
mišićnim ćelijama stimuliše cGMP-zavisnu protein kinazu (cGK) koja
aktivira specifične kalijumove (K+) kanale i time hiperpolariše mišiće
[35] (Šema br. 1). Imunocitohistometrijskom metodom detektovano je
prisustvo cGK u kontraktilnim elementima ileuma pacova, u kojima cGK ima
važnu ulogu. Takođe, enzim cGK je detektovan i u cirkularnom i
longitudinalnom glatkomišićnom sloju muskularis externa, dok je u
lamini muscularis mucosae detektovana izoforma cGK-Iβ [36]. Posredstvom
ovih mehanizama NO igra ključnu ulogu u intestinalnoj peristaltici [35].
Drugi potencijalni mehanizam delovanja NO u GIT-u se odnosi na uticaje
NO-a u otvaranju K+-kanala, koji posreduju u hiperpolarizacionom odgovoru
na inhibitornu neurotransmisiju [37] (Šema br.1). Najmanji deo
relaksacije indukovane NO-om je posledica: a) hiperpolarizacije
membranskog potencijala, b) inhibicije električne aktivnosti i c)
redukcije influksa Ca2+ kroz voltažno zavisne Ca2+-kanale [38].
Aktivacija K+-kanala se može indukovati direktnom stimulacijom uz posredstvo NO ili indirektno, uključivanjem cGMP-generišućeg sistema
[39, 40], što omogućava da biohemijski i električki mehanizmi
koegzistiraju i zajedno posreduju u inhibitornim efektima NO [37].
Od važnosti je takođe napomenuti da NO može smanjiti koncentraciju
unutar ćelijskog Ca2+, ili smanjiti osetljivost kontraktilnih elemenata
na Ca2+, što rezultira u relaksaciji glatkih mišića [41]. Relaksantno
delovanje NO, takođe, može biti usled inhibicije oslobađanja neurotransmitera acetilholina i supstance P [42].
EFEKTI NO-a NA GLATKE MIŠIĆE GIT-a
Endogeni NO igra ključnu ulogu u kontroli gastro-intestinalnog
motiliteta i koordinira relaksaciju i kontrakciju glatko mišićnih
ćelija. NO oslobođen iz NANC nerava i iz vaskularnog endotelijuma
pojačava vazodilataciju i povećava protok krvi u mukozi [43]. Dokazano
je da - egzogeni NO oponaša relaksatorni efekt nitrergičkog transmitera
ali da, s druge strane, smanjuje relaksaciju prouzrokovanu endogenim NO
[44]. U glatkim mišićima GIT-a, NO, kao i donori NO, izazivaju različite
odgovore, u koje su uključene relaksacija, kontrakcija, relaksacija
praćena kontrakcijom ili kontrakcija praćena relaksacijom, što zavisi od
tipa NO donora, tkiva i vrste [45].
|
|
| |
Najšire prihvaćeno delovanje NO-a u crevu je uticaj NO-a na relaksaciju
glatkih mišića [46], direktnim inhibitornim delovanjem NO-a na
intestinalne mišiće GIT-a [47, 48]. Pored toga, NO takođe prouzrokuje i
kontrakcije posredovane acetilholinom [49], i pored činjenice da je
stimulusima izazvano oslobađanje acetilholina i tahikinina iz enteričkih
neurona inhibirano NO-om [50]. Kontraktilni efekt natrijum nitroprusida
(NaNP), vazodilatatora i donora NO-a, na longitudinalne mišiće ileuma
zamorčića je u skladu sa sposobnošću egzogenog NO-a da kontrahuje ileum
zamorčića [49]. Ekscitatorno delovanje NaNP-a na enteričke neurone
najverovatnije je posledica stimulacije ekscitatornih motornih puteva
ili delovanja tonično oslobođenih ekscitatornih neurotransmitera [51,
52]. Metilensko plavilo, koje je inhibitor sGC, ne utiče na kontrakcije
prouzrokovane NaNP-om, ali značajno inhibira relaksaciju [53], usled
inhibicije sGC [54, 55]. Literaturni podaci ukazuju da NaNP može
stimulisati peristaltiku [56] i da inhibira enteričke motorne reflekse
[57] i peristaltičku aktivnost [58]. Pokazano je da u fiziološkim
uslovima, intestinalni motilitet nije kontrolisan tonički oslobođenim
NO-om. Povišena koncentraci-ja NO-a u nekim patofiziološkim uslovima,
kao što je npr. sepsa može modulirati spontane kontrakcije [59]. Ovo
višestruko delovanje NO-a sugeriše da manipulacija NO sistemom utiče na
enteričke motorne reflekse i peristaltiku tankog creva na kompleksan
način [52, 60].
NITRERGIČKA NEUROTRANSMISIJA I GAS-TROINTESTINALNA PATOLOGIJA
Poslednjih godina nitrergička neurotransmisija je privukla naučno
interesovanje za izučavanje oštećenja nitrergičke inervacije u GIT-u. NO
je važan medijator procesa koji deluju na intestinalni motilitet udružen
sa mukoznom permeabilnošću i oštećenjima [61]. Inkubacija intestinalnih
epitelnih ćelija visokim koncentracijama donora NO-a, rezultira
povećanjem stepena ćelijske oštećenosti (smanjuje se vijabilnost
epitelnih ćelija) [62]. Literaturni podaci ukazuju da je cGMP
potencijalni medijator ćelijskog oštećenja u ileumu [63, 64], pri čemu
inhibitori cGMP-fosfodiesteraze tipa 5, kao što je zaprinast [65],
povećavaju stepen NO-uzrokovanog oštećenja, a da inhibitori sGC-a
redukuju oštećenja indukovana delovanjem NaNP-a [64]. Takođe, pokazano
je da NO u dozi manjoj od 1 μM izaziva oštećenja koja nisu u direktnoj
korelaciji sa povećanjem ćelijskog sadržaja cGMP-a, pri čemu je moguće
da su u ova oštećenja uključeni cGMP-nezavisni mehanizmi intestinalnih
ćelijskih oštećenja [64]. Ova oštećenja mogu biti rezultat direktne
citotoksičnosti NO-radikala [66]. U mukozi GIT-a, analozi NO-a, kao i
cGMP-a pojačavaju influks Ca2+ [67, 68], pri čemu je povećanje
koncentracije citosolnog Ca2+ udruženo sa oštećenjima u mnogim ćelijama,
uključujući gastrične mukozne ćelije [69, 70].
Disfunkcija neurona koji proizvode NO u mijenteričkom pleksusu mogu
prouzrokovati različite bolesti u GIT-u. Jedan od faktora može biti
poremećaj regulacije aktivnosti NOS u autonomnim nervima. Smanjeno
oslobađanje NO i/ili smanjena ekspresija nNOS su važan parametar kod
pacijenata sa funkcionalnom dispepsijom. Redukcija u sintezi nNOS u
mijenteričkom pleksusu je važan faktor u patofiziologiji Ahalazije,
dijabetične gastropareze, infantilne hipertrofične pilorične stenoze i
Hiršprungso-ve bolesti. [71].
Kod pacijenata sa dijagnostifikovanom Ahalazijom, koju karakteriše
poremećaj smanjenja sposobnosti donjeg ezofagusnog sfinktera da se
relaksira, nije moguće odrediti aktivnost NOS biohemijskim merenjem
transformacije 14C-L-arginina u 14C-L-citrulin ili imunohistohemijski
primenom specifičnih antitela na nNOS [72]. S toga se pretpostavlja da
je nedostatak prisustva NOS-a u donjem ezofagusnom sfinkteru, važan
parametar u patofiziologiji Ahalazije [73].
Hirschsprungova bolest je karakteristična po odsustvu mijenteričkog
pleksusa u distalnom kolonu što ima za posledicu konstrikciju
nerelaksirajućih segmenata [74]. Imunohistohemijska analiza NOS-a takođe
pokazuje odsustvo NOS u mišićnom sloju u mijenteričkom pleksusu
aganglionarnog kolona kod pacijenata sa dijagnostikovanom
Hirschsprungovom bolešću, dok je distribucija NOS u ganglionarnom kolonu
istih pacijenata bila slična onoj kod osoba sa normalnim kolonom.
Takođe, pretpostavka je da poremećaj motiliteta kod osoba sa
Hirschsprunsovom bolešću može biti posledica značajnog smanjenja i/ili
gubitka ekspresije gena za nNOS [75].
Zahvalnica:
Ovaj rad je realizovan uz finansijsku podršku Ministarstva za nauku i
zaštitu životne sredine, projekat br. 143030 (E.R.I.)
LITERATURA
- Suzuki H, Ward SM, Bayguinov YR, Edwards FR, Hirst GDS.
Involvement of intramuscular interstitial cells in nit-rergic
inhibition in mouse gastric antrum. J Physiol (Lond) 2003;
546:51-763.
- Postorino A, Serio R, Mule F. Nitric oxide is involved in non-adrenergic,
non-cholinergic inhibitory neurotransmis-sion in rat duodenum. J
Auton Pharmacol 1995; 15:65-71.
- Sanders KM, Ward SM. Nitric oxide as a mediator of nonadrenergic
noncholinergic neurotransmission. Am J Physiol 1992; 262:G379-G392.
- Taddei S, Virdis A, Ghiadoni L, Salvetti A. Endothelial
dysfunction in hypertension: Fact or fancy? J Cardiovasc Pharmacol
Suppl 1998; 3:41–48.
- LaPointe M, Isenovic E. Interleukin-1ß regulation of in-ducible
nitric oxide synthase and cyclooxygenase-2 in-volves the p42/44 and
p38 MAPK signaling pathways in cardiac myocytes. Hypertension 1999;
33:276-282.
- Isenovic E, LaPointe M. Role of Ca++ phospholipase A2 on
regulation of inducible nitric oxidesynthase. Hyperten-sion 2000;
35:249-254.
- Mungrue IN, Bredt DS, Stewart DJ, Husain M. From molecules to
mammals: what’s NOS. Acta Physiol Scand 2003; 179:123–135.
- Mayer B, Hemmers B. Biosynthesis and action of nitric oxide in
mammalian cells. Trends Biochem Sci 1997; 22:477-481.
- Sarkar R, Webb RC. Does nitric oxide regulate smooth muscle cell
proliferation? J Vasc Res 1998; 35:135-142.
- Kim PK, Zamora R, Petrosko P, Billiar TR. The regulatory role of
nitric oxide in apoptosis. Int Immunopharmacol 2001; 1:1421–1441.
- Ziche M, Morbidelli L. Nitric oxide and angiogenesis. J
Neurooncol 2000; 50:139–148.
- Burnett AL. Nitric oxide control of lower genitourinary tract
functions: a review. Urology 1995; 45:1071–1083.
- Thaler CD, Epel D. Nitric Oxide in Oocyte Maturation, Ovulation,
Fertilization, Cleavage and Implantation: A lit-tle dab’ll do ya.
Curr Pharm Des 2003; 9:399–409.
- Frank S, Kampfer H, Wetzler C, Pfeilschifter J. Nitric oxide
drives skin repair: Novel functions of an established mediator.
Kidney Int 2002; 61:882–888.
- Stamler JS, Meissner G. Physiology of nitric oxide in ske-letal
muscle. Physiol Rev 2001; 81:209–237.
- Eu JP, Sun J, Xu L, Stamler JS, Meissner G. The skeletal muscle
calcium release channel: coupled O2 sensor and NO signaling
functions. Cell 2000; 102:499–509.
- Roberts CK, Barnard RJ, Scheck SH, Balon TW. Exercise-stimulated
glucose transport in skeletal muscle is nitric oxide dependent. Am J
Physiol 1997; 273:E220–E225.
- Coleman JW. Nitric oxide: a regulator of mast cell activa-tion
and mast cell-mediated inflammation. Clin Exp Immunol 2002;
129:4–10.
- Zoran Gluvić, Goran Koricćanac, Emilija Lazić, Aleksan-dra
Stojaković, Vesna Popović, Biljana Putniković, et al. Nitric oxide
and its role in pathophysiological conditions. Materia Medica 2006;
22(1):23-30.
- Isenovic RE, Muniyappa R, Milivojevic N, Rao Y, Sowers JR. Role
of PI3-kinase in isoproterenol and IGF-1 induced ecNOS activity.
Biochem Biophys Res Commun 2001; 285:954-958.
- Alemayehu A, Lock KR, Coatney RW, Chou CC. L-NAME, nitric oxide
and jejunal motility, blood flow and oxygen uptake in dogs. Br J
Pharmacol 1994; 111:205-212.
- Stark ME, Szurszewski JH. Role of nitric oxide in gastroin-testinal
and hepatic function and disease. Gastroenterology 1992;
103:1928-1949.
- Bredt DS, Huang PM, Snyder SH. Localization of nitric oxide
synthase indicating a neural role for nitric oxide. Nature 1990;
347:768-770.
- Costa M, Furness JB, Pompolo S, Brookes SJ, Bornstein JC, Bredt
DS et al. Projections and chemical coding of neurons with
immunoreactivity for nitric oxide synthase in the guinea-pig small
intestine. Neurosci Lett 1992; 148:121-125.
- Ward SM, Xue C, Shuttleworth CW, Bredt DS, Snyder SH, Sanders
KM. NADPH diaphorase and nitric oxide synthase colocalization in
enteric neurons of canine proximal colon. Am J Physiol 1992;
263:G277-G284.
- Timmermans JP, Barbiers M, Scheuermann DW, Bogers J.J,
Adriaensen D, Fekete E et al. Nitric oxide synthase immunoreactivity
in the enteric nervous system of the developing human digestive
tract. Cell Tissue Res 1994; 275:235-245.
- Kanada A, Hata F, Suthamnatpong N, Maehara T, Ishii T, Takeuchi
T et al. Key roles of nitric oxide and cyclic GMP in nonadrenergic
and noncholinergic inhibition in rat il-eum. Eur J Pharmacol 1992;
216:287–292.
- Van Geldre LA, Fraeyman NH, Peeters TL, Timmermans JP, Lefebvre
RA. Further characterisation of particulate neuronal nitric oxide
synthase in rat small intestine. Auton Neurosci 2004; 110(1):8-18.
- Salapatek AM, Wang YF, Mao YK, Lam A, Daniel EE. Myogenic nitric
oxide synthase activity in canine lower esophageal sphincter:
morphological and functional evi-dence. Br J Pharmacol 1998;
123:1055-1064.
- Chakder S, Bandyopadhyay A, Rattan S. Neuronal NOS gene
expression in gastrointestinal myenteric neurons and smooth muscle
cells. Am J Physiol 1997; 273 (Cell Physiol 42):C1868-C1875.
- Fleming I, Gray GA, Schott C, Stoclet JC. Inducible but not
constitutive production of nitric oxide by vascular smooth muscle
cells. Eur J Pharmacol 1991; 200:375-376.
- Bredt DS. Endogenous nitric oxide synthesis: biological
functions and pathophysiology. Free Rad Res 1999; 31:577-596.
- Ignarro LJ, Degnan JN, Baricos WH, Kadowitz PJ, Wolin MS.
Activation of purified guanylate cyclase by nitric ox-ide requires
heme. Comparison of heme-deficient, heme-reconstituted and heme-containing
forms of soluble en-zyme from bovine lung. Biochim Biophys Acta
1982; 718:49.
- Jun CH, Lee TS, Sohn UD. NO/cyclic GMP pathway mediates the
relaxation of the feline lower oesophageal sphincter. Auton Autacoid
Pharmacol 2003; 23:159-166.
- Brenman JE, Houhui X, Chao DS, Black SM., Bredt DS: Regulation
of neuronal nitric oxide synthase through alter-native transcripts.
Dev Neurosci 1997; 19:224-231.
- Kerins DM, Robertson RM, Robertson D. Drugs used for the
treatment of myocardial ischemia. In: Hardman JG, Limbird LE,
editors. Goodman and Gilman's The Pharma-cological Basis of
Therapeutics. 10th edition New York: McGraw-Hill, 2001- p. 843-871.
- Mule F, Angelo SD, Serio R. Tonic inhibitory action by nitric
oxide on spontaneous mechanical activity in rat proximal colon:
Involvement of cyclic GMP and apamin sensitive K+ channels. Br J
Pharm 1999; 127:514-520.
- Mule F, Angelo SD, Amato A, Contino I, Serio R. Modula-tion by
nitric oxide of spontaneous mechanical activity in rat proximal
colon. J Autonomic Pharmacol 1999; 19:1-6.
- Bolotina VM, Najibi S, Palacino JJ, Pagano PJ, Cohen RA: Nitric
oxide directly activates calcium-dependent potassi-um-channels in
vascular smooth muscle. Nature 1994; 368:850-853.
- Koh SD, Campbell JD, Carl A, Sanders KM: Nitric oxide activates
multiple channels in canine colonic smooth mus-cle. J Physiol 1995;
489:735-743.
- Karaki H, Ozaki H, Hori M, Mitsui-Sato M, Amano KI, Harada HI,
et al. Calcium movements, distribution and function in smooth muscle.
Pharmacol Rev 1997; 49:157-230.
- Mang CF, Truempler S, Erbelding F, Kilbinger H. Modula-tion by
NO of acetylcholine release in the ileum of wild-type and NOS gene
knockout mince. Am J Phsyol 2002; 283:G1132-G1138.
- Toda N and. Herman AG. Gastrointestinal function regula-tion by
nitrergic efferent nerves. Pharmacol Rev 2005; 57:315–338.
- De Man JG, Boeckxstaens GE, De Winter BY, Moreels TG, Herman AG,
Pelckmans PA. Inhibition of non-adrenergic non-cholinergic
relaxations by nitric oxide do-nors. Eur J Pharmacol 1995;
285:269-74.
- Tanović A, Jimenez M, Fernandez E. Actions of NO donors and
endogenous nitrergic transmitter on the longi-tudinal muscle of rat
ileum in vitro: mechanisms involved. Life Sci 2001; 69:1143-1154.
- Sanders KM, Ward SM. Nitric oxide as a mediator of nonadrenergic
noncholinergic neurotransmission. Am J Physiol 1992; 262:G379-G392.
- Radivojša S, Milovanović SR. The Influence of Vasodila-tators on
the Contractile Activity of the Isolated Guinea Pig Ileum. In:
Abstract book of 5th Congress of the European Association for
Clinical Pharmacology and Therapeutics, 12-15 September 2001, Odense,
Denmark, p. 80.
- Lyster DJK, Bywater RAR, Taylor GS, Watson MJ. Effects of a
nitric oxide synthase inhibitor on non-cholinergic junction
potentials in the circular muscle of the guinea pig ileum. J Auton
Nerv Syst 1992; 41:187-196.
- Bartho L, Lefebvre RA. Nitric oxide-mediated contraction in
enteric smooth muscle. Arch Int Pharmacodyn 1995; 329:53-66.
- Wiklund CU, Leone AM, Gustafsson LE, Moncada S. Release of
nitric oxide evoked by nerve stimulation in gui-nea pig intestine.
Neuroscience 1993; 53:607-611.
- Radivojša S, Varagić V, Milovanović S. The Role of Nitric Oxide
in Neurotransmission in the Guinea Pig Ileum. 13th Balkan
Biochemical Biophysical Days and Meeting on Metabolic Disorders,
12-15 October 2003, Kusadasi, Turkey, Turkish Journal of
Biochemistry 2003; 28 (3):124.
- Holcer P, Lippe ITH, Tabrizi AL, Lenard L, Bartho L. Dual
excitatory and inhibitory effect of nitric oxide on peristalsis in
the guinea pig intestine. J Pharmacol Exp Ther 1997; 280:154-161.
- Martin W, Villani GM, Jothianandan D, Furchgott RF. Selective
blockade of endothelium-dependent and glyceryl trinitrate-induced
relaxation by hemoglobin and by methylene blue in the rabbit aorta.
J Pharmacol Exp Ther 1985; 232:708-716.
- Radivojša S, Milovanović SR, Spasić M, Varagić VM. The Influence
of Sodium-Nitroprusside on the Contractile Activity of the Isolated
Guinea Pig Ileum. In: Abstract book of 5th Congress of the European
Association for Cli-nical Pharmacology and Therapeutics, 12-15
September 2001, Odense, Denmark, p. 80.
- Moncada S, Higgs A. Mechanism of disease: The L-arginine-nitric
oxide pathway. N Engl J Med 1993; 329:2002-2012.
- Sugisawa K, Komori S, Takewaki T, Ohashi H. Stimulati-ve effect
of sodium nitroprusside on peristaltic reflex in isolated guinea pig
ileal segments. Jpn J Pharmacol 1991; 57:279-289.
- Lyster DJK, Bywater RAR, Taylor GS, Watson MJ. Effects of a
nitric oxide synthase inhibitor on non-cholinergic junction
potentials in the circular muscle of the guinea pig ileum. J Auton
Nerv Syst 1992; 41:187-196.
- Waterman SA, Costa M. The role of inhibitory motoneu-rons in
peristalsis in the isolated guinea pig small intestine. J Physiol
1994; 477:459-468.
- Grasa L, Rebollar E, Arruebo MP, Plaza MA, Murillo MD. The role
of NO in the contractility of rabbit small intestine in vitro:
Effects of K+ channels. J Physiol Pharmacol 2005; 56:407-419.
- Radivojša S: Uticaj vazodilatatora na kontraktilnu aktivnost
izolovanog ileuma zamorca. Magistarski rad, Biološki fakultet,
Beograd, 2003.
- Izzo AA, Mascolo N, Maiolino P, Capasso F. Nitric oxide-donating
compounds and cyclic GMP depress the sponta-neous contractile
activity of the isolated rabbit jejunum. Pharmacology 1996;
53:109-113.
- Tepperman BL, Brown JF, Korolkiewiez R, Whittle BJR. Nitric
oxide synthase activity, viability and cyclic GMP levels in rat
colonic epithelial cells: effect of endotoxin challenge. J Pharmacol
Exp Ther 1994; 271:1477-1482.
- Frandsen A, Schousboe A, Griffiths R. Cytotoxic actions and
effects on amino acids in cultured cerebral neurons. J Neurosci Res
1993; 34:331-339.
- Tepperman BL, Abrahamson TD, Soper BD. The role of cyclic
guanylate monophosphate in nitric oxide-induced injury to rat small
intestinal epithelial cells. J Pharmacol Exp Ther 1998; 284:929-933.
- Tuncel BI and Sadan G. Effects of phosphodiesterase V inhibition
on nitric oxide-mediated relaxation responses in guinea pig trachea.
Pharmacology 2004; 71(2):102-6.
- Moncada S, Palmer RM, Higgs EA. Nitric oxide: physiology,
pathophysiology, and pharmacology. Pharma-col Rev 1991; 43:109-142.
- Magliola L, Jones AW. Sodium nitroprusside alters Ca2+ flux
components and Ca2+ dependent fluxes of K+ and Cl- in rat aorta. J
Physiol 1990; 421:411-424.
- Tripp MA, Tepperman BL. Role of calcium in nitric oxide-mediated
injury to rat gastric mucosal cells. Gastroenterology 1996;
111:65-72.
- Farber JL. The role of calcium in lethal cell injury. Chem Res
Toxicol 1990; 3:503-508.
- Tepperman BL, Tan SY, Whittle BJR. Effect of calcium modifying
agents on integrity of rabbit isolated gastric mucosal cells. Am J
Physiol 1991; 261:G119-G127.
- Takahashi T. Pathophysiological significance of neuronal nitric
oxide synthase in the gastrointestinal tract. J Gastro-enterol
2003;38(5):421-30.
- Mearin F, Mourelle M, Guarner F, Salas A, Riveros-Moreno V,
Moncada S et al. Patients with achalasia lack nitric oxide synthase
in the gastro-oesophageal junction. Eur J Clin Invest 1993;
23:724-728.
- Lui H,Vanderwinden JM, Ji P, De Laet MH. Nitric oxide synthase
distribution in the enteric nervous system of chil-dren with cardiac
achalasia. Chin Med J (Engl) 1997; 110(5):358-61.
- Vanderwinden JM, De Laet MH, Schiffmann SN. Nitric oxide
synthase distribution in the enteric nervous system of
Hirschsprung’s disease. Gastroenterology 1993; 105:969-973.
- Kusafuka T, Puri P. Altered mRNA expression of the neuronal
nitric oxide synthase gene in Hirschsprung's disease. J Pediatr Surg.
1997; 32(7):1054-8.
Autor za korespodenciju:
Snežana Tepavčević,
Institut za nuklearne nauke "Vinča", p.o.box 522,
11001 Beograd, Srbija
tel: 011-244-2532; fax: 011-2455-561
e-mail:
sradivojsa@rt270.vin.bg.ac.yu
Rad predat: 12.2.2007.
Rad prihvaćen: 25.3.2007.
Elektronska verzija objavljena: 8.5.2007. |
|