|
|
||||||||||||||
| UDK 616-008.9 | ISSN 0350-2899, 28(2003) 3-4 p.91-96 | |||||||||||||
Prikaz bolesnika Morbus Wilson - prikaz slučajaVladimir Mitov |
||||||||||||||
| Sažetak: Wilsonova bolest predstavlja progresivno autozomno recesivno oboljenje, koje karakterišu poremećaj transporta i prekomerna akumulacija bakra u jetri, CNS-u, očima i drugim organima. U osnovi je autozomno recesivno prenosivi defekt gena za ATP-azu, tip-P, za protein koji vezuje bakar (Cu) u serumu (Copper-Binding P-type ATPase). Kod svih pacijenata postoji prekomerna akumulacija Cu u jetri, bazalnim ganglijama i talamusu, taloženje bakra u vidu prstenova u Descementovoj membrani cornee, Kajzer-Flajšer-ov prsten. Pacijent Ž. S. rođen 1975. god. u Zaječaru. Na osnovu biopsije jetre , vrednosti Cu i ceruloplazmina, 1987. god. u Institutu za majku i dete postavljena je dijagnoza Wilson-ove bolesti. Od 1997. manifestni neurološki, ekstrapiramidalni, simptomi, 2002, prvi put hospitalizovan zbog anemije, koja je sekundarnog tipa, kao posledica hemolize u Wilson-ovoj bolesti (uočena i pri prvoj hospitalizaciji). Za vreme bolničkog lečenja dijagnostikovana je i bubrežna insuficijencija koja može biti posledica nakupljanja bakra u tubulima i/ili nefrotoksičnosti Penicilamina. Reč je o terminalnoj bubrežnoj insuficijenciji , na terapiji hemodijalizom. Ključne reči: Vilsonova bolest, ceruloplazmin, bakar, ekstrapiramidalna simptomatologija |
||||||||||||||
UvodMorbus Wilson se naziva i Kinnier Wilsonova bolest, Westphal-ova
pseudoskleroza, Westphal- Strümpell-ova bolest, Westphal-Strümpell-ova
pseudoskleroza, Westphal-Strümpell-ov sindrom, Wilson-Konoval-ova
bolest. |
||||||||||||||
IstorijatPrvi je obolenje opisao Friedrich Theodor von Frerichs 1854. godine (3.) zatim Karl Friedrich Otto Westphal 1883. (4.) i Adolf von Strümpell 1898. godine (5.). Ime von Frerichs-a se kasnije ne spominje iako je prvi ovo obolenje nazvao porodičnom hepatolentikularnom degeneracijom. Westphal i Strümpell opisali su klinički sindrom vrlo sličan multiploj sklerozi, koji je po njima dobio ime Vestfal-Štimpelov-a pseudoskleroza. Samuel Alexander Kinnier Wilson 1912. (6.) opisuje neurološki poremećaj koji prati izraziti tremor i podseća na parkinsonizam. Uočio je da je ovo porodično oboljenje, koje je udruženo sa cirozom jetre. Od tada usvojen je naziv Wilsonova bolest, sa kliničkim oblicima u kojima su zahvaćene bazalne ganglije nervnog sistema i jetra, odakle i potiče naziv hepatolentikularna degeneracija. U novije vreme spominje se i N. V. Konovalov koji oboljenje naziva hepato-cerebralnom distrofijom (7.). |
||||||||||||||
Metabolizam bakraBakar je oligoelement, koji se u organizmu nalazi u mozgu, jetri, manje u bubrezima, srcu, kosi. Ukupna količina oko 80 mg. Najvećim delom se apsorbuje u duodenumu, i to L-amino kiselinama i proteinom, za koji se vezuje na luminarnoj strani mukoze. U mukozi se vezuje za Metalotioneinu sličan protein, koji je bogat sulfhidrilnim grupama, i formira merkaptidne veze. Ovaj protein je ujedno i depo Cu u mukozi, a samim tim je i bitan u homeostatskoj regulaciji nivoa Cu u organizmu. Cu se oslobađa na seroznoj strani mukoze i ulazi u cirkulaciju, gde se vezuje za albumine i transportuje do jetre. U jetri se deponuje u vidu Kuproproteina. Iz jetre odlazi u cirkulaciju, gde se 90-95% transportuje vezan za Ceruloplazmin a preostalih 5-10% labavo vezani za albumine ili u eritrocitima u vidu Eritrokuprona. Bakar je u organizmu neophodni deo mnogih metaloenzima, čiji poremećaj utiče na metabolizam:
Do sada su poznate 3 bolesti - posledice poremećaja metabolizma bakra:
|
||||||||||||||
EtiopatogenezaU osnovi oboljenja je autozomno recesivna malformacija u sintezi α2
globulina, proteina Ceruloplazmina. Zbog nedostatka transportnog
proteina bakra, ceruloplazmina, povećava se nivo slobodnog bakra u
cirkulaciji i vezanog za albumine plazme. Vezivanje Cu za albumine je
slabim vezama, što omogućava njegovo taloženje u jetri, CNS-u, očima i
drugim organima.
|
||||||||||||||
Klinička slikaJetra: Nervni sistem: Oči: Bubrezi: Ostalo: |
||||||||||||||
DijagnozaNa dijagnozu ukazuju: postojanje hepatitisa ili ciroze jetre nejasne etiologije kod mlađih.
|
||||||||||||||
TerapijaOsnovni lek je Penicilamin, a u upotrebi je od 1956. godine.
Penicilamin gradi helatna jedinjenja sa Cu, na ovaj način mobiliše bakar
iz tkiva i povećava njegovo izlučivanje urinom, od 1000-3000 µg/24h.
Primena Penicilamina može dati i nusefekte: osip, ulcerozni stomatitis,
leukopeniju, trombocitopeniju, aplastičnu anemiju, nefrotski sindrom,
defekt vitamina B6, Cinka. |
||||||||||||||
Prikaz pacijentaPacijent Ž. S. rođen je 1975. god. u Zaječaru. Radi preglednosti, istorija bolesti biće prikazana hronološkim redom. I Hospitalizacija - Infektivno odeljenje; Pedijatrija 12.XI-2.XII
1987. god. II Hospitalizacija – Institut za majku i dete, Beograd 4.XII
1987.-2.II 1988. god. III Hospitalizacija – Neuropsihijatrija, Zaječar 16.X - 30.X
1997 god Ambulantni pregledi – Neurološka klinika, Beograd IV Hospitalizacija – Interno odeljenje, Zajčar.20.XI -26.XI
2002. god V Hospitalizacija – Interno odeljenje; Nefrologija, Zaječar 2.XII
-16.XII 2002. god VI Hospitalizacija – Beograd, 16.XII - 26.XII 2002. god VII Hospitalizacija – Nefrologija, Zaječar 27.XII 2002.-15.I
2003. god |
||||||||||||||
 |
||||||||||||||
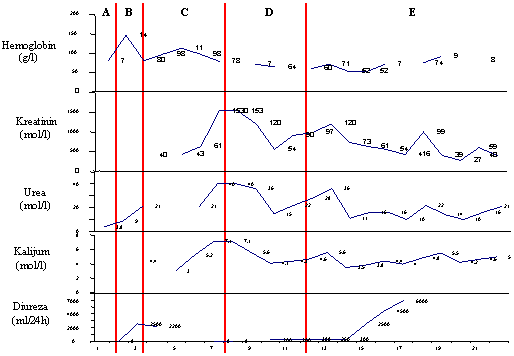
| Tabela 1.: Prikaz vrednosti Hemoglobina, Kreatinina, Uree, Kalijuma i Diureze u odnosu na periode hospitalizacije (A, B, C, D, E) | ||||||||||||||
 |
 |
|||||||||||||
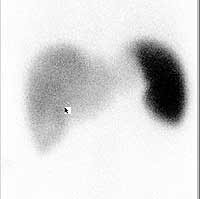
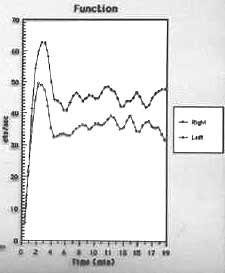
| Slika 1.: Scintigrafija jetre | Slika 2.: Dinamska scintigrafija bubrega | |||||||||||||
Zaključak
|
||||||||||||||
Literatura
|
||||||||||||||
| Zahvaljujem se kolegama Internog odeljenja i Službe nefrologije i hemodijalize na pomoći u dijagnostici i lečenju prikazanog pacijenta. | ||||||||||||||
|
Adresa autora: Vladimir Mitov Novosadska 16/1, 19000 Zaječar e-mail: mitov@ptt.yu |
||||||||||||||
|
Rad primljen: 21. V 2003. Rad prihvaćen: 7. VII 2003. |
||||||||||||||
|
|
||||||||||||||
| Infotrend Crea(c)tive Design | Revised: 20 May 2009 | |||||||||||||
