 |
Glasilo Podružnice Srpskog lekarskog društva Zaječar
Godina 2004 Volumen 29 Broj
3 |
|
|
|
|
[ Home ] [ Gore/Up ][ <<< ] [ >>> ]
|
|
| |
UDK: 616.441-07 |
ISSN 0350-2899,
29(2004) 3 p.175-189 |
|
| |
Pregledni članakIspitivanje tiroidne građe i funkcije
Aleksandar Aleksić, Željka Aleksić
Zdravstveni centar Zaječar, Služba za nuklearnu medicinu, Zaječar |
|
| |
|
|
| |
Sažetak:
Kod pacijenata sa suspektnom bolešću tiroidne žlezde (TŽ) lekar treba da
dođe do dve vrste dijagnoza, etiološke ili anatomske, koja otkriva uzrok
ili prirodu poremećaja, kao i udružene patološke promene u žlezdi, i
funkcionalne dijagnoze, koja podrazumeva procenu fiziološkog i
metaboličkog stanja pacijenata uslovljenih nivoom tireoidnih hormona. U
radu je dat pregled do sada korišćenih testova za ispitivanje građe i funkcije
tiroidne žlezde, kao i napomene o mogućim tumačenjima i ograničenjima ovih
testova.
Ključne reči: tiroidna žlezda, funkcijski testovi, morfološki
testovi
Napomena: sažetak na engleskom jeziku
Note: summary in English |
|
| |
|
|
| |
UVOD
Potpuna dijagnoza kod pacijenata sa oboljenjem tiroidne žlezde (TŽ), a
koja je preduslov za odgovarajuću terapiju (Th), postavlja se povezivanjem
podataka iz anamneze (o simptomima), kliničkim pregledom (uočavanjem
znakova bolesti, palpatornim nalazom na TŽ) i na osnovu rezultata laboratorijskih
testova (1).
Laboratorijski testovi (LT) sa sve većom specifičnošću i senzitivnošću
omogućavaju otkrivanje disfunkcije TŽ i kod pacijenata kod kojih su
klinički znaci oskudni ili maskirani koincidentnim netiroidnim bolestima)
(1).
Svaki od ovih testova ima i svoja ograničenja i nije potpuno pouzdan u
dijagnostici svih oboljenja TŽ. Uticaj mnogobrojnih egzogenih i endogenih
činilaca na vrednosti rezultata ovih testova komplikuje njihovo tumačenje.
Cilj ovog preglednog članka je da se ukratko prikažu dijagnostički testovi
koji su do sada korišćeni za utvrđivanje morfofunkcijskog tiroidnog
statusa. |
|
| |
|
|
| |
|
|
| |
TESTOVI ZA ISPITIVANJE TIROIDNE GRAĐE I FUNKCIJE
Testovi za ispitivanje tiroidne građe i funkcije mogu se podeliti u četiri
kategorije: A. IN VIVO TESTOVI
- funkcijski:
• test radiojodne fiksacije
• test fiksacije tehnecijum pertehnetata (TcU)
• "kratki" test fiksacije tehnecijum pertehnetatom (kratki TcU)
• test supresije tiroidnim hormonima
• perhloratni test
- morfološki:
• kompijuterizovana tomografija
• nuklearna magnetna rezonanca
• ehosonografija TŽ
• aspiracija TŽ tankom iglom
- morfofunkcijski:
• scintigrafija TŽ
• Color Flow Doppler sonografija (CFDS)
• test stimulacije sa TSH
• fluorescentni sken
• pozitronska emisiona tomografija
B. IN VITRO TESTOVI • određivanje serumske koncentracije ukupnih tireoidnih hormona (TT4, TT3)
• određivanje serumske koncentracije slobodnih tireoidnih hormona (FT3,
FT4)
• određivanje serumske koncentracije TSH
• test stimulacije sa TRH
• određivanje serumske koncentracije TBG
• određivanje indeksa slobodnih hormona (FT4I i FT3I) i THBR (thyroid
hormone binding ratio) C. TESTOVI ZA OCENU METABOLIČKOG UTICAJA TIROIDNIH HORMONA • nivo bazalnog metabolizma
• serumska koncentracija holesterola
• serumska koncentracija specifičnih enzima (CPK, LDH, SGOT, SGPT, AP)
• trajanje Ahilovog refleksa
• trajanje srčanih intervala D. OSTALI TESTOVI (IN VIVO I IN VITRO) • određivanje antitiroidnih antitela (TgAb, TPOAb, TRAb)
• određivanje serumske koncentracije tireoglobulina (Tg) A. 1. FUNKCIJSKI IN VIVO TESTOVI
A. 1. 1. Test radiojodne fiksacije
Ovaj test se zasniva na principu određivanja kapaciteta štitaste žlezde da
nakuplja jod u vidu jodida iz cirkulacije u određenom vremenskom periodu.
Za test mogu da se koriste 131-J ili 123-J u obliku natrijum-jodida koji
se daje per-os (ređe intravenski) u dozi od 0.185-0.37MBq. Merenja se vrše
scintilacionom sondom sa natrijum-jodidnim kristalom i sa posebnim
kolimatorom, a na standardnoj udaljenosti 35cm od TŽ, nakon 3 i nakon 24h.
U zdravoj populaciji vrednost fiksacije zavisi od količine joda u vodi i
hrani, te svaka ustanova mora iz statistički reprezentativnog uzorka
zdrave populacije da odredi normalne vrednosti. Normalne vrednosti za naše
područje su 8-20% za 3h i 20-45% za 24h.
Neke egzogene supstance mogu uticati na smanjenje fiksacije, te umanjiti
vrednost ovog funkcionalnog testa (tab. 1).
Test radiojodne fiksacije gubi svoj značaj u funkcionalnoj dijagnostici
oboljenja TŽ od pojave osetljivih In vitro testova. Danas se ovaj test
koristi za potvrdu dijagnoze subakutnog (De Quervaine-ovog) tiroiditisa i
za izračunavanje terapijske doze radiojoda kod hipertireoze (2).
Rano merenje, 20-30 minuta posle intravenske aplikacije markera, ukazuje
prvenstveno na sposobnost preuzimanja joda (trapping). Ako se merenje
obavlja između 2 i 6 sati po davanju joda, ocenjuje se i preuzimanje i
organifikacija joda u žlezdi. Kasni test, 24 sata posle aplikacije joda, u
velikoj meri je pod uticajem veličine izlaska joda (u vidu jodiranih
proizvoda) iz žlezde. U zdravih osoba, najveća vrednost fiksacije dobija
se 24-48 sati posle date doze. U difuznoj toksičnoj strumi sa velikim
prometom u žlezdi obim fiksacije je veći u ranom periodu, nekada se
maksimum postiže već nakon 3 sata posle aplikacije, dok je vrednost posle
24 sata manja od prvobitno izmerene vrednosti (Slika 1). U hroničnom
tiroiditisu u ranijoj fazi bolesti ukupni obim fiksacije je obično
povećan, stepen fiksacije je obično viši u ranim periodima, dok kasnije
opada, ali je ovde razlog funkcionalno oštećenje tkiva (3). U tabeli 4
dati su činioci koji utiču na fiksaciju radiomarkiranih supstanci.
Povećanje fiksacije radioaktivnog joda nalazi se u hipertiroidizmu,
graviditetu, deficitu joda, oporavku posle akutnog i subakutnog
tiroiditisa, posle ukidanja tirosupresivne terapije i u stanjima sa povećanim
gubitkom joda iz organizma. Sniženo vezivanje nalazi se u primarnom i
sekundarnom hipotiroidizmu, kod terapijske primene egzogenih TH, u akutnom
i subakutnom tiroiditisu, povećanom unosu egzogenog joda, kongestivnoj
srčanoj insuficijenciji, bubrežnoj insuficijenciji i primeni nekih lekova
(tionamida, glikokortikoida, fenilbutazona) (4). Tabela 1. Uticaj
nekih egzogenih supstanci na rezultate testa radiojodne fiksacije
| Jodirani lekovi |
Mexaform, Amiodaron, Hexoral, |
Par meseci |
| Jodirane kontrastne materije |
Bronhografije, mijelografije i I.V. pijelografije |
Do godinu dana |
| Tiroidni hormoni |
Vobenol, Tivoral |
Do trideset dana |
| Steroidni hormoni |
|
Par dana |
| Strumogene namirnice |
Repa, kelj, kupus, karfiol, soja |
Par meseci |
|
|
| |
|
|
| |
1. Hipertiroidizam
2. Bolest bubrega
3. Normalna krivulja fiksacije radiojoda
4. Hipertiroidizam sa brzim prometom
5. Hipotiroidizam
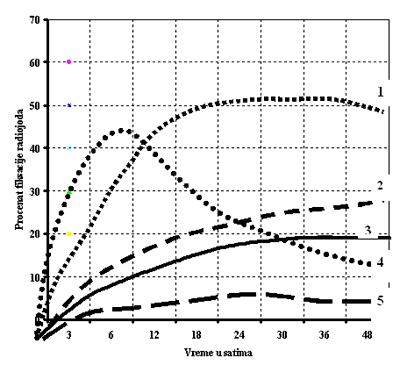
Slika 1. Tipične krivulje fiksacije radiojoda u pojedinim funkcijskim
stanjima tiroidne žlezde |
|
| |
|
|
| |
A. 1. 2. Test fiksacije tehnecijum pertehnetata
Jon pertehnetata (99mTcO4-) TŽ zahvata istim mehanizmom kao i jodid, s tim
što se pertehnetat dalje ne organifikuje. Korišćenjem tehnecijuma za test
fiksacije smanjuje se radijaciona absorbovana doza i sam test kraće traje.
Merenje aktivnosti nad štitastom žlezdom vrši se 20 minuta nakon I.V.
injekcije pertehnetata gama kamerom sa pinhol kolimatorom vezanim za
kompijuter. Fiksacija (uptake) se računa upoređivanjem aktivnosti nad TŽ
korigovanom za ‘’background’’ i aktivnosti standardne doze. Normalne
vrednosti 99mTcO4- uptake-a (TcU) kreću se od 0.24-3.4% (4). Pacijenti
koji imaju povećane vrednosti fiksacije radiojoda imaće takođe povećane
vrednosti tehnecijumskog uptake-a, dok kod pacijenata sa smanjenom
vrednošću radiojodne fiksacije uptake tehnecijuma može i ne mora biti
snižen. Na primer, povišeni TcU a niska fiksacija radiojoda mogu se naći
kod Hashimotovog tiroiditisa, stanja posle radiojodne terapije, ili kod
pacijenata koji su na tireosupresivnoj terapiji (5).A. 1. 3. Kratki test fiksacije tehnecijum pertehnetata
Paunković i sar. su osamdesetih godina razradili kratki (petominutni) test
akumulacije pertehnetata u TŽ kojim su izbegli brojne merne korekcije (za
ekstratiroidnu aktivnost, za atenuaciju, za radioaktivni raspad) pri I.V.
testovima akumulacije pertehnetata i jodida u ranoj fazi. Test se koristi
za procenu autoimune stimulacije TŽ kod imunogene hipertireoze.
Nakon I.V. aplikacije 50-80MBq tehnecijum pertehnetata bolesniku, vrši se
kontinuirano merenje radioaktivnosti nad TŽ gama kamerom sa paralelnim
kolimatorom povezanom sa kompjuterom u toku pet minuta. Iz "regiona od
interesa" nad TŽ dobija se kriva aktivnost/vreme, a TcU se izračunava iz
odnosa priraštaja (slope) izraženog u radioaktivnim impulsima u sekundi i
aktivnosti nad graničnikom A koji deli završetak "vaskularne faze"
(trenutke akumulacije) od početka rane akumulacije. Priraštaj se meri u
linearnom delu krive omeđenom prethodno navedenim graničnikom A i
graničnikom B, koji se postavlja na kraju linearnog priraštaja (najčešće
oko 3 minuta) od graničnika A. Indeks slope/A se iz praktičnih razloga
množi sa 1000.
Vrednosti kratkog TcU su uvek povišene (preko 5) kod nelečene Gravesove
bolesti za razliku od bolesnika sa diseminovanom tireoidnom autonomijom (DTA).
Povišene vrednosti se takođe nalaze kod obolelih od Gravesove bolesti u
remisiji kod kojih je i dalje povišen TRAb. Stoga, test pre meri autoimunu
stimulaciju, a ne funkciju - paralelizam postoji između vrednosti ovog
testa i TRAb, a ne vrednosti ovog testa i koncentracije T3 (6).
A. 1. 4. Test supresije tiroidnim hormonima
Supresivni test, koji je u praksu testiranja hipofizo-tiroidne osovine
uveo Werner 1956. godine, zasniva se na pretpostavci da je u eutiroidizmu
ovaj regulacioni mehanizam očuvan, a u hipertireozi poremećen. Mada je ta
empirička opservacija tačna, mehanizam tog teksta nije pravilno tumačen u
vreme kada je masovno korišćen (šezdesete godine). U praksi je korišćen za
diferenciranje bolesnika sa povišenim testom fiksacije i klinički
eumetaboličnim stanjem. Test se izvodi posle prethodno urađenog testa
fiksacije, i to tako što se bolesniku da 300mcg L-tiroksina dnevno tokom
sedam dana (ili desetodnevnom aplikacijom farmakoloških doza
trijodtironina), nakon čega se ponavlja radiojodna fiksacija ili
scintigrafija TŽ (2, 7).
Ako je 24h fiksacija manja za 60% od predhodne radi se o eutiroidnom
stanju, a ako je ostala nepromenjena ili se snizila za manje od 60% radi
se o hipertireozi.
Ako se na ponovljenom scintigramu vidi samo hiperfunkcijski čvor, a
paranodalno tkivo bude suprimirano, u pitanju je toksični adenom, a ako se
i dalje prikazuje paranodalno tkivo, u pitanju je difuzna struma sa
funkcionim čvorom (Sy Marine-Lehnard) (2).
U novije vreme se ovaj test koristio za procenu "oporavka" TŽ nakon
lečenja hipertireoza, za predviđanje recidiva nakon ukidanja medikamentne
terapije, i slično.
U svetlu današnjeg znanja o "patološkoj tireoidnoj stimulaciji" test se
interpretira na drugi način: povišena fiksacija radiojoda posledica je
ektopične, patološke stimulacije TSH receptorskim antitelima (TRAb), a ne
fiziološke (TSH), i iz tog razloga nije supresibilna tiroidnim hormonima.
Perzistencija negativnog supresivnog testa nakon ukidanja medikamentne
terapije indirektno ukazuje da su i dalje prisutne znatne količine TRAb,
koje su vesnik i uzrok recidiva hipertireoze (7).
Danas se ovaj test praktično ne koristi, jer postoje senzitivni funkcijski
i imunološki testovi koji ga zamenjuju.
A. 1. 5. Perhloratni test
Ovaj test služi za utvrđivanje poremećaja organifikacije joda kod struma i
Hashimoto tiroiditisa. Perhloratni jon (ClO4-) ulazi u TŽ kao i jon
jodida, a u slučaju poremećaja organifikacije joda, perhloratni jon
istiskuje neorganifikovani jod iz TŽ. Kad god je radiojodna fiksacija
povišena po jodavidnom tipu (TŽ "gladna" za jodom), treba uraditi perhloratni
test.
Nakon merenja tročasovne fiksacije radioaktivnog joda u TŽ, bolesniku se
da KClO4 500mcg I.V. ili 1g peroralno i 15 minuta po aplikaciji ponovo
izmeri fiksacija. Ako se fiksacija smanjila za 50% u odnosu na bazalnu
vrednost, test je pozitivan i dokazuje defekt organifikacije joda, što se
vidi kod kongenitalnih struma sa defektom organifikacije ili Hashimoto
tiroiditisa (3, 4). |
|
| |
|
|
| |
A. 2. MORFOLOŠKI IN VIVO TESTOVI
A. 2. 1. Kompjuterizovana tomografija (CT)
Metoda se u svakodnevnoj kliničkoj tiroidologiji veoma malo primenjuje, s
obzirom na to da ultrazvučni pregled najčešće dopunjen scintigrafskim
pruža praktično kompletnu informaciju o stanju morfologije žlezde. Mesto
CT-a u tiroidnoj dijagnostici veoma je značajno u dijagnostici tumora TŽ,
posebno kada su smešteni retrosternalno i medijastinalno. Zahvaljujući
prisustvu joda, TŽ ima veći stepen apsorpcije (visok CT broj) u odnosu na
okolne mekotkivne strukture vrata, a ujedno se vide i promene u
morfologiji žlezde. Visok CT broj još više se povećava davanjem jodnog
kontrastnog sredstva i na taj način se omogućuje razlikovanje TŽ od drugih
tumora vrata i medijastinuma, uključujući tu i arterijske aneurizme (3).
A. 2.2. Nuklearna magnetna rezonanca (NMR)
NMR koristi magnetno polje i radiofrekventne talase (Rf) koji se emituju u
specifičnim pulsnim sekvencijama da bi odslikali odabrane "slojeve" u telu
sa kontrastima u slici koji zavise od karakteristike tkiva. Upotreba NMR-a
omogućila je vizualizaciju anatomskih slojeva tela bez upotrebe jonizujućeg
zračenja. Meka tkiva se ovom metodom prikazuju veoma visokim stepenom
rezolucije, te mogu detektovati veoma male patološke promene (4).
Širom primenom NMR utvrđeno je da su T1 i T2 parametri izmenjeni u
benignim kao i u malignim promenama, stoga jasna diferencijacija ovih
promena nije moguća. Benigne i maligne promene mogu se delimično
razlikovati po obimu poremećaja tkivne građe i znacima invazije okolnih
struktura. Za sada je tehnika NMR-a u fazi istraživanja i nije odlučujuća
u preoperativnoj obradi bolesnika sa solitarnom masom (3).
A. 2.3. Ehosonografija TŽ
Ehosonografija TŽ kao neinvazivna metoda, veoma komforna za bolesnika,
pruža korisne informacije o morfologiji ovog organa, dok u odnosu na funkciono
stanje ne daje direktne informacije. U nekim dijagnostičkim šemama bolesti
TŽ ova metoda zauzima prvo mesto među dopunskim pregledima, a tek na
osnovu rezultata ovog pregleda odlučuje se da li je potrebna scintigrafija,
aspiraciona punkcija ili neka druga dopunska dijagnostička metoda.
U danas korišćenim frekvencama ultrazvuka nije poznato oštećenje tkiva,
tako da se ispitivanje može ponavljati, a koristi se u dece i u trudnica
(8).
Ehosonografija je objektivni postupak u oceni promena veličine i strukture
žlezde. Sposobnost rezolucije je velika, otkrivaju se solidni nodusi
prečnika 3 mm, dok je minimalna rezolucija cističnih promena ranga
vrednosti 5 mm. Pored utvrđivanja samog nodusa, utvrđuje se i njihov broj.
Ehosonografija je vodeći neinvazivni postupak u diferencjaciji cističnih
od solidnih lezija. Ultrazvučna dijagnostika ne može da razdvoji benigne i
maligne promene. Preporučuju se dva znaka kao pokazatelji benigne prirode
lezije, apsolutno cistična promena i znak haloa. Hipoehogena priroda
nodusa u poređenju sa okolnim tkivom smatra se jednim od indikatora za
malignu prirodu promene (3). Na osnovu ovih činjenica indikacije za
ehosonografski pregled su difuzno ili nodozno uvećanje TŽ praćenje
postoperativnog toka kod tumora TŽ I interventna ehosonografija (ciljana
punkcija, evakuacija ciste, sklerozacija ciste ili toksičnog adenoma).
Kontraindikacije za ovaj pregled praktično ne postoje
Na slikama 6. i 7. su dati neki od ehosonografskih nalaza. |
|
| |
|
|
| |
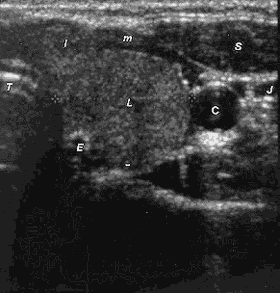 |
Slika 2. Sonogram levog režnja TŽ u poprečnoj ravni koji pokazuje
zaokrugljen režanj strume. L-uvećan režanj, I-proširen istmus, T-traheja,
C-karotidna arterija, J-jugularna vena, S-sternokleidomastoidni mišić, E-ezofagus. |
|
| |
|
|
| |
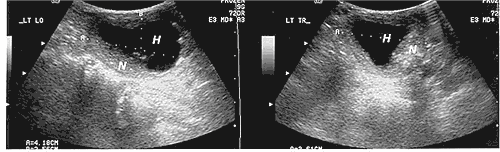
Slika 3. Sonogram koji pokazuje uzdužni (levo) i poprečni (desno) presek
levog režnja u kome je degenerisani tiroidni nodus. N-nodus, H-regija
hemoragične degeneracije
A. 2. 4. Aspiracija TŽ tankom iglom (FNA) i citologija
Pre uvođenja FNA (fine needle aspiration biopsy), za postavljanje
histološke dijagnoze radila se lobektomija ili otvorena biopsija žlezde.
Niska incidenca kancera u solitarnim nodusima učinila je da ove procedure
postanu manje privlačne kada su uvedene bezbednije i neinvazivnije
tehnike. Pošto mnogi klinički nalazi u solitarnom nodus ne razdvajaju
benigni od malignog procesa, potrebne su efikasnije metode za selekciju
bolesnika koji treba da se leče hirurškim putem. FNA se može koristiti za
prilično efikasnu diferencijaciju ovih mogućnosti i za dalje praćenje
bolesnika (8).
Indikacije za punkciju su svaka struma, odnosno uvećanje TŽ. Međutim
najčešća indikacija jeste scintigrafski hladan nodus TŽ. Aspiraciona punkcija
je način da se pravovremeno otkrije supstrat ovakvih promena i da se
indikuje operacija, odnosno spreči u krajnjoj liniji nepotrebna operacija.
Ukoliko je cista, vrši se evakuciona i dijagnostička punkcija, a ukoliko
se radi o solidnom tkivu, posebno ukoliko je to "hipoehogeno hladno
polje", aspiraciona punkcija je obavezna i presudna u donošenju odluke o
operaciji.
Kontraindikacije za punkciju su veoma retke i jedinu apsolutnu
kontraindikaciju čini oboljenje krvi, odnosno poremećaj hemostaze.
Relativne kontrainidikacije su kod plućnog emfizema, gde postoji mogućnost
da se ispod donjeg pola TŽ nalazi a. subclavia te postoji mogućnost lezije
iste, kod izraženog proširenja venskog crteža vrata takođe postoji
mogućnost povrede vene. Isto tako kod akutnog tiroiditisa navodi se
mogućnost stvaranja apscesa. Kao relativna kontraindikacija navodi se
tuberkulozni tiroiditis (8).
Pri ocenjivanju citološkog nalaza koriste se različite klasifikacije, među
kojima je najprihvatljivija ona koju daje Sekcija za TŽ Udruženja
endokrinologa Nemačke i koja je takođe postavljena prema kriterijumima za
dijagnostiku tumora. Prema ovoj klasifikaciji, citološki nalaz je podeljen
na pet grupa:
- grupa - neupadljiv nalaz, normalne ćelije - tirociti
- grupa - pored normalnih tirocita, makrofazi, degenerativne promene,
ćelijski elementi karakteristični za zapaljenje
- grupa - dvostruka ćelijska abnormalnost, polimorfizam, polihromazija,
anizonukleoza
- grupa - izražena ćelijska atipija, sumnja na malignitet
- grupa - "pozitivan" nalaz, masivna ćelijska atipija, jasne tumorske
ćelije.
Većina autora smatra da je citologija ispunila zadatak ukoliko je postavila
sumnju na malignitet.
Pored scintigrafije i ultrasonografije, citologija se smatra obaveznom
dijagnostičkom metodom u preoperativnoj pripremi bolesnika (8).
A. 3. MORFOFUNKCIJSKI IN VIVO TESTOVI
A. 3. 1. Scintigrafija tiroidne žlezde
Scintigrafija TŽ predstavlja morfofunkcionu vizualizaciju nakon unošenja
dijagnostičke doze različitih obeleživača. Najveća vrednost scintigrafije
je u tome što ona ne daje anatomsku sliku nego tzv. funkciono-topografsku.
To znači da su na slici predstavljeni samo funkcionišući delovi žlezdanog
tkiva ma gde se oni nalazili. Za scintigrafiju se koriste različiti
obeleživači od kojih su najčešće u primeni 99mTcO4- (tehnecijum
pertehnetat), 131J, 123J, 201Tl, metajodbenzilgvanidin (MIBG), dimerkaptosukcinilna
kiselina (DMSA) i imunoscintigrafija. Aparati na kojima se vrši
scintigrafija su skeneri ili gama kamere. Scintigrafija može biti statička
ili dinamička. U tabelama 2 i 3 dati su radioizotopi i radiofarmaci u
upotrebi za scintigrafiju tiroidne žlezde kao i indikacije za
radionuklidni sken područja TŽ.
Statička scintigrafija izvodi se primenom tehnecijumpertehnetata koji se
daje i. v. i već nakon 15-20 minuta pravi se scintigram, i primenom 131J
koji se daje per os, a scintigrafija se vrši nakon 24h. U svakodnevnoj
praksi prednost se daje prvoj metodi slikanja, dok se druga primenjuje u
nekim nodusnim strumama, u slučajevima sumnje na tumor, ektopičnu TŽ i
dishormonogenezu.
Čvorovi TŽ scintigrafski se mogu detektovati ako su promera najmanje 1 cm.
Prema intezitetu nakupljanja radionuklidnog obeleživača dele se na:
funkcione (tople), hipofunkcione (relativno hladne), afunkcione (hladne) i
hiperfunkcione (vruće).
Dinamska scintigrafija, perfuziona ili angioscintigrafija TŽ predstavlja
njeno dinamsko ispitivanje tokom prvog prolaza radioobeleživača. Benigni
afunkcioni nodus dinamskom scintigrafijom pokazuje se u arterijskoJ fazi
angiograma vaskularizovan u istom stepenu kao i u okolno tkivo, a maligni
afunkcioni nodus se prikazuje kao hipervaskularizovan. Cistični afunkcioni
nodus prikazuje se kao avaskularan, a toksični adenom se prikazuje kao
dobro vaskularizovan nodus, ali se prikazuje i okolno tkivo.
Na slikama 4-7 su prikazani scintigrafski nalazi u nekim oboljenjima TŽ,
kao i scintigrafija normalne TŽ.
|
|
| |
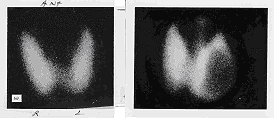 |
Slike 4 i 5. Scintigram normalne TŽ sa
99mTcO4- (levo); desno ivično
"hladno" polje u levom režnju TŽ (nefunkcijski nodus). |
|
| |
|
|
| |
|
|
| |
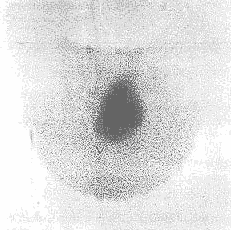 |
Slika 6. Scintigrafija TŽ sa
99mTcO4- - "vruć" nodus označava autonomno
funkcijski nodus (toksični adenom) sa supresijom okolnog tkiva TŽ. |
|
| |

Slika 7. Scintigram TŽ sa 131I - difuzna toksična struma
(difuzno pojačano
vezivanje obeleživača u difuzno uvećanoj TŽ). |
|
| |
|
|
| |
|
|
| |
Tabela 2. Radioizotopi i radiofarmaka u upotrebi za scintigrafiju tiroidne
žlezde
| AGENS |
MEHANIZAM VEZIVANJA |
KLINIČKA UPOTREBA |
| Radiojod 131I |
Preuzimaju ga i organifikuju
folikulske ćelije za biosintezu
tiroidnih hormona |
Slikovit prikaz
Terapija |
| Radiojod 123I |
Test radiojodne fiksacije (RAIU) |
| Radiojod 124I |
|
| 99mTcO4- |
Preuzimaju ga folikulske ćelije ali ga ne
organifikuju |
Test akumulacije pertehnetata (TcU) i slikovit prikaz |
| 201Talijum (TI) hlorid |
Vezivanje srazmerno protoku (Na-K-pumpa) |
Slikovit prikaz (nije pod uticajem TSH) |
| Metajodbezilgvanidin (MIBG) |
Aktivno vezivanje joda za amine (Analog endogenog
noradrenalina koji sledi isti. Na zavisni mehanizam intracelularnog
nakupljanja u citoplazmatskim vezikulama) |
Prikaz medularnog tiroidnog karcinoma
|
| 99mTc (V) dimerkaptosukcinat (DMSA) |
Nepoznat |
Prikazivanje medularnog tiroidnog karcinoma |
| Anti CEA monoklonska antitela |
Vezivanje za ćelijski antigen |
Prikaz medilarnog tiroidnog karcinoma |
Fluorin-18 fluorodeoxyglucose
(F18 FDG) |
Vezivanje i fosforilacija glikoze (pojačana glikoliza
u tumoru) |
PET procena biološke prirode mase |
|
|
| |
|
|
| |
|
|
| |
Tabela 3. Indikacije za radionuklidni sken područja TŽ
| 1. Otkrivanje anatomskih varijanti i traganje za ektopičnim tkivom |
| 2. Dijagnoza kongenitalne atireoze |
| 3. Određivanje prirode mase na vratu i u medijastinumu |
| 4. Evaluacija solitarnih nodusa |
| 5. Evaluacija tiroidnih ostataka nakon operacije |
| 6. Detekcija funkcijski aktivnih metastaza |
| 7. Evaluacija fokalnih tiroidnih poremećaja |
|
|
| |
|
|
| |
|
|
| |
Tabela 4. Činioci koji utiču na fiksaciju radiomarkiranih supstanci
| POVEĆANO VEZIVANJE |
SNIŽENO VEZIVANJE |
| Hipertiroidizam |
Primarni hipotiroidizam |
| Trudnoća |
Centralni hipotiroidizam |
| Deficit joda |
Egzogeni TH |
| Oporavak nakon akutnog i subakutnog tiroidita |
Akutni i subakutni tiroiditis |
| Oporavak nakon primene tirosupresiva |
Kasna faza hroničnog tiroiditisa |
| Litijum |
Renalna insuficijencija |
| Rani stadijum hroničnog tiroiditisa |
Kongestivna srčana insuficijencija |
| Gubitak TH stolicom mokraćom itd |
Unos egzogenog joda |
|
|
| |
|
|
| |
|
|
| |
A. 3. 2. Color Dopler Flow Imaging
Ovom tehnikom dobijen je sistem dvojnog skeniranja, pomoću kojeg se uz
morfološke mogu simultano pratiti i hemodinamske promene. Doppler signali
se kodiraju bojom i nalaze su u crveno-plavom spektru. Protok krvi prema
sondi označen je crvenom, a od sonde plavom bojom, pri čemu svetlije
nijanse kolornog spektruma odgovaraju većim brzinama protoka, dok mešavina
ukazuje na turbulentan tok. Kolor Doppler ehosonografska ispitivanja
odnose se uglavnom na hipertiroidizam, gde se ističe višestruko povećanje
hemodinamike u i onako bogato vaskularizovanom organu, te se pojavljuje
kao obilna kolorna signalizacija koja preplavljuje žlezdu (8 - 15).
Kolor Dopler sonografija TŽ kod Graves-ove bolesti može pokazati difuznu
hiperemiju TŽ (tzv. "tiroidni pakao"). Kod pacijenata sa amiodaronom
indukovanom tirotoksikozom (AIT) Doppler flow sonografija, kako je
objavljeno, razlikuje dva tipa poremećaja, što ima značaja za terapiju (Th).
Pacijenti sa umerenim do velikim vaskularnim protokom imaju u osnovi
tireoidnu bolest, kao sto su latentna Graves-ova bolest ili nodozna struma
i u riziku su za jodom indukovanu tirotoksikozu (AIT-tip I), dok oni koji
nemaju evidentan vaskularni protok nemaju ni očiglednu prethodnu tiroidnu
bolest (AIT-tip II). Klinička vrednost ove opservacije je ta što se
pacijenti sa tipom II AIT uspešno leče glikokortikoidima. Nasuprot njima,
pacijenti sa AIT tip I pokazuju dobar Th odgovor na kombinovanu primenu
metimazola i kalijum-perhlorata (16). Eutiroidni amiodaronom lečeni
pacijenti takođe ne pokazuju hiperaktivni protok.
Kolor flow Doppler sonografija (KFDS) može imati ulogu u izboru optimalne
doze metimazola potrebne za održavanje eutiroidnog stanja(17). Takođe ima
izveštaja u kojima se indeksi hemodinamike TŽ procenjeni sa CFDS uspešno
koriste za predviđanje remisije i relapsa, kao i potrebe za ablativnom
terapijom kod pacijenata sa GB koji nemaju adekvatan odgovor na
medikamentnu tireosupresivnu terapiju (17, 18).
A. 3. 3. Test stimulacije sa TSH
Ovaj test služi za potvrdu autonomnog toksičnog adenoma i u
diferencijalnoj dijagnozi primarne i centralne hipotireoze.
Nakon scintigrafije na kojoj se zapaža hiperfunkcioni (vrući) nodus radi
se stimulacija sa TSH tri dana i.m. po 10 IU (jedna ampula Ambinona), a
četvrtog dana se ponavlja scintigrafija, na kojoj bi trebalo, ako se radi
o toksičnom adenomu, da se pojavi paranodalno tkivo koje je prethodno bilo
suprimirano.
Ako se dobije niska vrednost radiojodne fiksacije, ovim testom moguće je
izdiferencirati primarnu (gde se vrednost dvadesetčetvoročasovne fiksacije
ne menja nakon trodnevne stimulacije sa TSH) od centralne hipotireoze (gde
dolazi do porasta dvadesetčetvoročasovne radiojodne fiksacije za > 50% u
odnosu na bazalnu). U intaktnoj žlezdi nakon stimulacije doći će do
porasta fiksacije za 30-50%.
Ovaj test je potisnut visokosenzitivnim In vitro frunkcionalnim testovima
(4).
A. 3. 4. Fluorescentni sken
Kvantitativni rentgen fluorescentni sken (RFS) se koristi za ocenu
solitarnih hladnih čvorova. Ovim postupkom se meri in vivo sadržaj joda u
solitarnom tiroidnom nodus (STN) i odgovarajućem području kontralateralnog
lobusa žlezde. Izračunati odnosa sadržaja joda koristi se kao kriterijum
za ocenu prirode promene, odnos sadržaja joda iznad 0,6 smatra se odličnim
pokazateljem za benignu prirodu (3).A. 3. 5. Pozitronska emisiona tomografija (PET)
Primenom pozitronskih emitera sa kratkim vremenom poluraspada ugrađenih u
AK ili UH moguće je dokazati njihovo veće nakupljanje u tkivu tiroidnog
tumora. Uobičajeno se koristi 18F-fluorodezoksiglukoza (FDG) kao analog D-glukoze.
Zbog svojih analognih metaboličkih osobina FDG se akumuliše u tkivu sa
povećanim metaboličkim potrebama. Zbog upotrebe obeleživača sa kratkim
vremenom poluraspada, stepen ozračivanja je veoma mali. Primena postupka
je ograničena mogućnostima nabavke pozitronskih emitera, koji se dobijaju
u ciklotronu i raspoloživom tehnikom za PET. Vrednost ovog postupka u
diferencijalnoj dijagnozi umanjena je nalazom da i benigne lezije mogu da
akumulišu FDG (3).
B. IN VITRO TESTOVI
Uravnotežena hipotalamo-hipofizo-tiroidna osovina je karakteristika
eutiroidizma. U teorijskom smislu, normalne koncentracije tiroidnih
hormona (njihovih slobodnih frakcija) omogućuju održavanje normalne
koncentracije TSH, pa bi određivanje ovog poslednjeg parametra (najbolje "ultrasenzitivnog"),
bilo dovoljno za dokazivanje eutiroidnizma. Međutim, nekoliko faktora ne
prati ovu logiku: često laboratoriji nije na raspolaganju kvalitetna
ustaljena metoda za ultrasenzitivni TSH (uTSH), ponekad je koncentracija
TSH granična (nedovoljno diskriminativna), nekada adenohipofiza bez obzira
na stanje TŽ ne sekretuje odgovarajuće količine TSH, i slično. Iz tih
razloga u praksi se određuju aktuelne koncentracije TH i TSH, a pribegava
se i testiranjima "tiroidne" odnosno "tirotropne" rezerve (7).
Ovi testovi podrazumevaju postupak u kome se biološki materijal dobijen od
ispitanika izvan organizma (In vitro) dovodi u vezu sa radioaktivnim (ili
nekim drugim obeležavajućim) materijalom i na taj način dobijaju
informacije o koncentraciji supstance u biološkom mterijalu.
Radioimunološke i radiosaturacione analize, kao i alternativni
neradioizotopni postupci, su mikroanalitičke tehnike bazirane na principu
reakcije između biološki aktivnih supstanci u telesnim tečnostima i
specifičnih vezujućih proteina (antitela, specifičnih transportnih
proteina, receptora).
Za markiranje u RIA (radio imunološki esej) najčešće se primenjuje J125, a neradioaktivni (supstanca koja se dozira u serumu) i radioaktivni antigen
u sistemu takmiče se za vezivna mesta antitela i nakon uspostavljanja
ravnoteže separiraju se frakcije i vrše odgovarajuća merenja i
izračunavanja na osnovu standardnih rastvora i standardne krive.
Imunoradiometrijske metode (IRMA) koriste obeležena antitela koja in vitro
formiraju kompleks sa antigenom (supstancom koja se dozira), a
radioaktivnost kompleksa srazmerna je koncentraciji merene supstancije.
Od mnogobrojnih varijanti najrasprostranjeniji je tzv. "sendvič" metod u
kojem se upotrebljavaju dva antitela (jedno obeleženo i jedno neobeleženo)
upravljena protiv dve različite determinantne grupe istog hormona, pri
čemu je zid epruvete obložen visoko specifičnim ne obeleženim entitelima.
Za vreme prve inkubacije sav ispitivani hormon se veže za antitela na zidu
epruvete putem prve antigen determinantne grupe (epitopa), a ostatak
uzorka se odbaci. Potom se u epruvetu dodaje drugo radiomarkirano antitelo
koje se vezuje za drugu antigen determinantnu (epitop) grupu hormona.
Potom se ispiranjem odbaci deo radiomarkiranog antitela koji je nevezan za
hormon. U epruveti ostaje samo radiomarkirano antitelo koje je vezano za
hormon a taj deo je direktno proporcionalan količini hormona u epruveti
odnosno uzorku.
IRMA u odnosu na RIA ima mnogo veću osetljivost, tj, mogućnost tačnog
određivanja veoma niskih koncentracija hormona, što je u nekim slučajevima
(npr. uTSH) veoma značajno. Zbog upotrebe monoklonskih antitela (antitela
koja su jednakog afiniteta i monospecifična, jer ih proizvode limfociti
istog tipa dobijaju se hibridoma-tehnologijom) i u prvoj fazi reakcije
(inkubacije) ovaj sistem ima znatno bolju specifičnost, čime se znatno
smanjuju greške zbog ukrštenih reakcija sa drugim hormonima.
Imunometrijski eseji sa neradioaktivnim obeleživačima koriste za
obeležavanje analita odnosno antitela enzim (EIA, ELISA), fluorescentne
materijale (FIA, IFMA, DELFIA, FPIA) i hemiluminiscentne materije (LIA,
ILMA).
U enzim imunološkim analizama kao enzim obeleživač najčešće se koristi
peroksidaza, koja u slučaju EIA ostaje aktivna u supernatantu a kod ELISA
(Enzyme Linked Immuno Sorbent Assay) je vezana za čvrstu fazu. U epruvetu
se dodaje substrat koji menja boju pri oksidaciji a čiji intenzitet zavisi
od količine prisutnog enzima tj. enzimom obeleženog analita.(Enzim je
vezan za antigen odnosno za materiju koju određujemo, nakon reakcije
antigen antitelo odvaja se vezana od slobodne frakcije Ag-At i dodaje
indikator sa kojim enzim stvara određenu boju određenog intenziteta
fotometrijskog na osnovu čega se određuje).
Kod FIA (Fluorescence Immuno Assay) i kod IFMA (Immuno Fluoro Metric
Assay) obeležavanje analita ili antitela vrši se pomoću fluorescentnog
obeleživača iz grupe lantanida - europiumom. Kod DELFIA (Dissociation
Enhanced Lanthanide Fluoro Immuno Assay) se nakon odigrane imunološke
reakcije vrši odvajanje, disocijacija lantanida iz kompleksa i omogućuje
se da on u posebnom rastvoru ima milion puta jaču fluorescenciju. Poseban
način registrovanja fluorescencije obeleženog analita postiže se
pobuđivanjem na fluorescenciju svetlošću određene talasne dužine i
polarizovanom u jednoj ravni - FPIA (Fluorescence Polarisation Immuno
Assay). Ovom metodom se zaobilazi predhodno razdvajanje kompleksa od
slobodnog analita jer samo obeleženi analit vezan za veliki molekul
antitela prilikom pobuđivanja emituje polarizovanu svetlost u istoj ravni
kao i ona kojom je bio pobuđen, dok se slobodni obeleženi analit nakon
pobuđivanja rotira i emituje svetlost koja nije polarizovana i ne
detektuje se.
Kod LIA (Lumino Immuno Assay) i ILMA (Immuno Lumino Metric Assay)
obeležavanje analita ili antitela vrši se hemiluminiscentnim materijama
(luminol, derivati luminola, akridinski estri) koje u kontaktu sa pogodnim
reagensima emituju vidljivu svetlost znatne jačine, a intenzitet
hemiluminiscencije očitava se u posebnim aparatima u vidu relativnih
svetlosnih jedinica.
Osetljivost, preciznost, tačnost i specifičnost predhodno navedenih metoda
se ne razlikuju međusobno bitno, a u poslednje vreme se pojavljuju i veoma
uspešne kombinacije nekih od ovih metoda npr. EIA i LIA (2).
B. 1. Određivanje serumske koncentracije ukupnih tiroidnih hormona TT3 i
TT4
Široko rutinsko korišćenje određivanje koncentracije ukupnog tiroksina u
serumu započelo je uvođenjem radiokompetitivnog metoda od strane
Murphy-jeve i Patee-a 1964. Kao vezujući nosač korišćen je TBG ekstrahovan
iz seruma ljudi, a kao ligandi koji kompetiraju za njegov kapacitet
vezivanja primenjeni su "obeleženi" tiroksin sa 125I i tiroksin iz seruma,
tl. ispitivani parametar. Radioimunološki metod određivanja hormona
(insulin, Yallow i Berson 1960.) uskoro je primenjen i za određivanje
tiroksina (Chopra 1972.) i trijodtironina (Gharib 1971.). Daljom
evolucijom laboratorijske tehnologije razvijeni su i drugi imunološki
metodi (enzimski, fluoroimunološki, luminiscentni).
Približno 99.96%T4 i 99.5%T3 nalazi se vezano za transportne proteine
(TBG,TBPA i albumin), dok se 0.04%T4 i oko 0.5%T3 nalazi u slobodnom
obliku cirkulacije. Za određivanje ukupnog T4 i ukupnog T3 (TT4 i TT3) u
serumu koriste se predhodno navedeni imunoeseji, koji su ograničeni
mogućim greškama u uslovima visoke ili niske koncentracije transportnih
proteina plazme.(7) U tabeli 5. data su stanja koja mogu da menjaju
koncentraciju transportnih proteina.
|
|
| |
Tabela 5. Stanja koja menjaju koncentraciju transportnih proteina u plazmi
| PORAST |
SNIŽENJE |
| Trudnoća |
Ciroza jetre |
| Estrogenizam posebno oralni kontraceptivi |
Nefrotski sindrom |
| Perfenazin, Metadon, Heroin |
Teške iscrpljujuće bolesti |
| Infektivni hepatitis |
Androgeni, kortikosteroidi |
| Akutna intermit. porfirija |
Difenilhidantoin, salicilati |
| Kongenitalni por. sinteze TBG-a |
Kongenitalna hipo TBG-emija |
| Disalbuminemije |
|
|
|
| |
|
|
| |
Redak uzrok porastu TT4 u serumu u odsustvu hipertireoidizma je periferna
rezistencija na tiroidne hormone (periferni kvaternerni hipotireoidizam,
Refetoff-ljev sindrom).
U većini laboratorija normalne vrednosti TT4 kreću se između 50 i 150 nmol/L
a TT3 od 1-3.5 nmol/L.
Kod hipertireoze povišeni su TT3 i TT4, stim što nivo TT3 može biti
nesrazmerno povišen u odnosu na nivo TT4 zbog pojačane periferne
konverzije i zbog veće neposredne sekrecije T3.
Normalne vrednosti T3 mogu se naći u retkim slučajevima "T4 tireotoksikoze".
"Pseudohipertireoidizam" sa visokim vrednostima TT4 i normalnim ili
sniženim TT3 bez hipermetabolizma viđa se kod pacijenata sa netiroidnim
sistemskim oboljenjima zbog defekta periferne konverzije T4 u T3. Kod
pacijenata sa teškim netiroidnim bolestima u kojih dolazi do promene
periferne konverzije T4 u T3 nalazi se sindrom niskog T3 ili "Euthyroid
sick Sy" koji ne zahteva supstituciju, a praćen je porastom rT3 (3).
B. 2. Određivanje serumske koncentracije slobodnih tiroidnih hormona FT3 i
FT4
Slobodne frakcije tiroidnih hormona (TH) difunduju u tkiva i ostvaruju
poznate efekte.
Koncentracija slobodnih TH meri se predhodno opisanim imunoesejima stim
što se oni moraju prvo izdvojiti iz seruma jednom od sledećih metoda:
dijalizne tehnike, ultrafiltracija, gel filtracija i adsorbcija.
Merenjem slobodnih frakcija hormona tačnije se utvrđuje tireoidni status u
odnosu na merenje ukupnih hormona zbog stanja koja menjaju koncentraciju
transportnih proteina plazme.
Normalne vrednosti FT4 su od 9.25-25 pmol/L, a FT3 od 3-9 pmol/L (3).
B. 3. Određivanje serumske koncentracije TSH
Određivanje koncentracije TSH je praktičan metod za dokazivanje primarne,
tiroidne hipotireoze. Povišena (nesuprimirana) koncentracija (preko 7
mU/L) ukazuje na smanjenu funkciju TŽ. Ovaj paranetar ipak nije dovoljno
diskriminativan, a pogotovo nije iskoristljiv za dokazivanje postojanja
hipertireoze (donja granica normalne za eutiroidne osobe za RIA je
praktično nemerljiva). Zato je započeto određivanje TSH senzitivnim (IRMA)
metodama, a u poslednje vreme i ultrasenzitivnim tehnikama.7 TSH u serumu
određuje se imunometrijskim metodama, a najsavremeniji eseji su ultrasenzitivni
(npr. DELFIA uTSH) koji precizno i reproducibilno detektuju tako niske
koncentracije kao što su 0.01-0.02 mU/L. Senzitivne metode za razliku od
ultrasenzitivnih detektuju najniže koncentracije od 0.5 mU/L.
S obzirom na ovo, određivanje TSH ultrasenzitivnom metodom može biti test
izbora i jedina trijažna metoda (jer je izuzetno pouzdan) za dokazivanje
hipertireoze. U posebnim slučajevima (bolesnici u skorašnjoj remisiji
hipertireoze, bolesnici sa najavom relapsa) određivanje uTSH treba
ponavljati uz određivanje koncentracije slobodnih frakcija TH (7).
Normalne vrednosti uTSH kreću se od 0.1-4 mU/ml. Kod hipertireoze
vrednosti uTSH su suprimirane (<0.1mU/ml) (3).
B. 4. Test stimulacije sa TRH
Ovaj test prvi je primenio Ormston 1971. Suština testa je u tome što
intravenski ubrizgan sintetski TRH vrlo brzo dovodi do otpuštanja TSH iz
hipofize (tirotropna rezerva), koji, posle izvesnog vremena, stimulira
otpuštanje TH (tiroidna rezerva). Postoje mnoge tehničke modifikacije
testa koje se sastoje u veličini doze (200 ili 400 mcg), načinu unošenja (intravenski
ili čak oralni u vrlo visokoj dozi), praćenim parametrima (TSH, T4, T3) i
intervalima u kojima treba pratiti porast nekog od tih parametara.
Najreprezentativniji parametar je porast koncentracije endogenog TSH u
intervalu od 30 minuta od aplikacije sintetskog TRH. Koncentracije
tiroksina se ne povećavaju statistički značajno 3 sata od aplikacije TRH,
dok nivo ukupnog trijodtironina statistički visoko raste.
Posle uvođenja određivanja TSH ultrasenzitivnim metodama značaj TRH testa
postaje znatno manji.
Mada se test najčešće koristi za procenu "tiroidne rezerve", tj. za
detekciju subkliničke hipotireoze, njime se indirektno vrlo sezitivno
dokazuje postojanje ektopične stimulacije (TRH test je negativan, jer je
endogeni TSH čvrsto suprimiran horonima TŽ, čija je sekrecija ektopično
stimulisana TRAb-om) (7).
Ovaj test se koristi za otkrivanje supkliničke hipotireoze i potvrdu
hipertireoze, kao i za razlikovanje centralnog (sekundarnog i tercijalnog)
hipotireoidizma.
Najpre se uzima krv za određivanje bazalne vrednosti TSH, zatim se I. V.
daje 200-400mcg TRH, a nakon 30min. ponovo uzima krv za određivanje TSH.
Normalno porast TSH nakon TRH stimulacije treba da bude između 5 i 30mU/l.
Kada je bazalna vrednost TSH niska uz povišene vrednosti TH, a nakon
stimulacije sa TRH ostaje i dalje niska (porast manji od 2mU/l), u pitanju
je hipertireoza.
Kada je bazalna vrednost normalna ili povišena, a nakon stimulacije raste
za više od 30mU/l u pitanju je primarna hipotireoza.
Kod centralne sekundarne hipotireoze bazalna vrednost TSH je nisko
normalna ili snižena, a nakon stimulacije nema porasta TSH, uz niske vrednosti
TH. Kod centralne tercijalne hipotireoze bazalne vrednosti TSH su niske
kao i TH, dok nakon stimulacije sa TRH dolazi do skoka TSH (2).
TRH test ima manji značaj u proceni funkcije hipofize. Odgovor TSH u
leziji hipofize je najčešće smanjen, ali može biti i normalan. U oštećenju
hipotalamusa viđa se normalan ili čak pojačan odgovor TSH, ali tek u 60.
minutu testa ili i kasnije (4).
Bitno je istaći i neke netiroidne parametre koji utiču na rezultat TRH
testa. U malom procentu kod zdravih osoba izostaje očekivani odgovor TSH u
toku testa, to su tzv. prirodni areaktori. Do smanjenog odgovora TSH
dovode: TH, glikokortikoidi, hormon rasta, somatostatin, dopaminski
agonisti, kalcitonin, verapamil, gladovanje, depresija, renalna
insuficijencija. Do porasta odgovora TSH dovode: estrogeni, cimetidin,
dopaminski antagonisti i pseudohipoparatiroidizam (4).
B. 5. Određivanje serumske koncentracijeTBGa
TBG u serumu meri se pomoću RIA i njegova vrednost je oko 260 nmol/L, a
lako je viši kod žena nego kod muškaraca. Iz koncentracije TBG-a i TT4 ili
TT3 mogu se izračunati FT4 i FT3 i tako zaobići ograničenja određivanja
ukupnih hormona u stanjima sa poremećajem koncentracije TBG (1). Ovaj test
se praktično vrlo retko jer postoje komercijalni kitovi za određivanje
slobodnih TH.
B. 6. Određivanje indeksa slobodnih hormona i THBR
Ovi testovi se danas retko koriste zbog postojanja komercijalnih kitova za
određivanje slobodnih hormona. Izvode se dodavanjem u serum pacijenta u
traserskoj količini obeleženog T4 ili T3 i inkubaciji sa solidnim
matriksom ili u epruveti obloženoj antitelima, pri čemu dolazi do
kompeticije u vezivanju obeleženih i neobeleženih hormona za solidnu fazu
ili antitela. Meri se udeo vezanog obeleženog hormona koji je obrnuto
proporcionalan ukupnoj koncentraciji nezauzetih veznih mesta u serumu, tj.
proporcionalan je slobodnoj frakciji T3 i T4 u serumu. THBR ima vrednost
od 0.85-1.1 a predstavlja odnos frakcije slobodnog obeleživača u serumu
pacijenta u odnosu na koncentraciju u normalnom serumu. Pošto je THBR
takođe proporcionalan slobodnoj frakciji TH u serumu, množenjem njegove
vrednosti sa koncentracijom ukupnih hormona može se proceniti
koncentracija slobodnih hormona tzv. FT4 i FT3 indeks (1).
Varijacije zasnovane na fiziološkim i patološkim uticajima
Cirkadijalni ritam. Iako se maksimum koncentracije TSH zapaža u kasnim
večernjim časovima, a minimum oko podneva, amplituda ovih varijacija je
mala, prosečno 0,95-2 mU/L. Gubitak noćnog skoka je rana manifestacija
centralnog hipotiroidizma i može imati dijagnoznu vrednost. Pojava
merljivog TSH samo u noćnom periodu dokazuje da je egzogena supresija
nepotpuna.
Sezonski uticaji. Sezonski uticaji i godišnje fluktuacije TSH i TH su
minimalni. Iako su od fiziološkog interesa, ove promene nisu dovoljne da
stvore zabunu u pogledu funkcije TŽ.
Spoljašnji uticaji. Reakcije na hladnoću su generalno adaptivni mehanizmi.
Zapažene promene nisu dovoljne da dovedu do zabune u tumačenju rezultata,
posebno ne u našim klimatskim uslovima.
Napor. Ispitivanja u žena koje se bave teškom atletikom i imaju amenoreu
nisu pokazala nikakav poremećaj u funkciji TŽ.
Patofiziološki uticaji. Preciznosti radi, treba podvući da se u
razmatranjima preanaliznih varijacija samo dva stanja pominju kao uzrok
zabuna u tumačenju rezultata. Prvo, trofoblastna bolest, u kojoj se u
velikim količinama stvara hCG koji normalno ima mali efekat sličan
tirotropinu. Neki trofoblastni tumori stvaraju proteine koji se sa većim
afinitetom vežu za TSH receptore. Zajedno sa velikom koncentracijom hCG,
ove promene su dovoljne da izazovu hipertiroidizam. Drugo stanje, struma
ovarii, koje se manifestuje prisustvom folikulskog tiroidnog tkiva u
jajniku, može da se potencijalno ispolji kao hipertiroidizam (3).
Neodgovarajuća (povišena) sekrecija TSH, zajedno sa jasnim kliničkim i
biohemijskim dokazima hipertiroidizma, može da dovede do sumnje u vrednost
dobijenih nalaza. Hipofizni adenom koji luči TSH je poznat već duže vreme,
a sve lakše se otkriva primenom novih senzitivnijih postupaka za
određivanje TSH. Merenje alfa subjedinice TSH daje dosta podataka, više od
80% hipofiznih adenoma kosekretuje slobodnu alfa subjedinicu. Ovo može
biti jedini dokaz protiv hipofizne rezistencije na TH ako studije
morfološkog izgleda hipofize ne otkrivaju nikakve promene. Sindrom
rezistencije na TH prepoznaje se po neodgovarajućoj sekreciji TH i TSH
(3).
Psihijatrijska stanja. Prolazni porast TSH i poremećaj koncentracije
ukupnih TH zapažaju se u psihijatrijskih bolesnika, ali su nedovoljno
objašnjeni. Zbog toga je neophodno više puta obnoviti merenja pre nego se
uvede terapija tiroidne disfunkcije.
Uticaji zasnovani na uzorku. Uopšteno, hemoliza, lipemija i ikterus ne
utiču bitno na imunooglede i oglede sa kompetitivnim vezivanjem. Staza
zbog stavljanja poveske ostaje značajan činilac koji utiče na stanje
uzoraka, posebno peptida i proteina koji nisu u ravnoteži sa
intersticijumskim sadržajem; proteinski sadržaj raste za 3-5% ako je
poveska plasirana duže 3 minuta (3).
Tiroksin je stabilan nekoliko dana na 4oC i više od 6 meseci na -20oC. Precipitacija proteina je moguća posle dužeg držanja u ledu, ali je ona
uticala na ranije testove. Epruvete sa preprekom od gela ne utiču na
savremene testove. Ispitivano je i održavanje uzoraka pune krvi od 1 sata
do 5 dana. Zapažene su mnogobrojne promene u ovako proveravanim uzorcima,
ali je držanje seruma u staklenim epruvetama na 4-8oC u najmanjoj meri
uticalo na interpretaciju dobijenih nalaza. Uopšteno promene su u svim
okolnostima minimalne i ne utiču na konačni rezultat, bar ne u meri da
uticaj bude klinički značajan (3).
Osušena kap krvi koristi se u neonatalnim programima testiranja za
kongenitalni hipotiroidizam. Tirotropin i ukupni tiroksin su potpuno
stabilni, a uspešno je određivan i FT4.
C. TESTOVI ZA OCENU METABOLIČKOG UTICAJA TIROIDNIH HORMONA
Procena nivoa bazalnog metabolizma, trajanja ahilovog refleksa i trajanja
srčanih intervala kao dijagnostičkih testova ima istorijski značaj i neće
se ovde podrobnije opisivati. Za detalje videti reference 1 i 19.
Nivo serumske koncentracije holesterola i nekih enzima (alkalna fosfataza,
sGOT, sGPT, CPK, LDH) su pokazatelji metaboličkog stanja organizma i u tom
smislu indirektno mogu ukazivati i na funkciju TŽ. Nivo AP, sGOT i sGPT
često je povišen u hipertiroidnim stanjima, dok je nivo holesterola
snižen. Povećanje holesterola i mišićnih frakcija CPK i LDH javljaju se
kod izrazitog hipotiroidizma (19).
D. OSTALI TESTOVI (IN VIVO I IN VITRO)
D. 1. Određivanje antitiroidnih antitela
Tiroglobulinska antitela TgAb pripadaju najčešće klasi IgG imunoglobulina,
i to klasi IgG1 i IgG4 dok su klase IgG2 i IgG3 slabo zastupljene. Ova
antitela ne fiksiraju komplement, ne učestvuju u reakcijama
antitelo-posredovane citotoksičnosti i ne indukuju citotoksične i
destruktivne promene.
Tg-anti-Tg sistem je prvi opisani antigen-antitelo sistem uključen u
autoimune procese. U to vreme je Tg smatran "skrivenim" antigenom (Ag),
čijim oslobađanjem dolazi do stimulacije imunog sistema i stvaranja
antitela (AT).
Iako se najveći deo metabolizma Tg odvija u tirocitima pod dejstvom
proteaza, izvestan broj nerazgrađenih molekula dospeva u limfotok a potom
u opštu cirkulaciju.
U cirkulaciji se normalno nalazi do 50 pmol/L Tg, s tim što je utvrđeno da
se u serumu pojedinih zdravih ljudi ne može da otkrije.
Tg iz seruma se može određivati u serumu metodom aglutinacije taniranih Er
(TRCA), RIA metodom ili ELISA tehnikom.
Normalan titar TgAb je 1:125, a povišen je kod 65-95% bolesnika sa
Hashimoto tireoiditisom, 60-90% bolesnika sa Gravesovom bolešću, prolazno
i u manjem stepenu u 50-75% bolesnika sa subakutnim tireoiditisom, umereno
povišen kod ostalih oboljenja TŽ (razne strume, malignitet), ali i kod 16%
normalne populacije iznad 65 godina (3).
Antitela prema tiroidnoj peroksidazi TPOAb. TPOAb pripadaju najčešće
klasi IgG imunoglobulina, i to klasi IgG1 i IgG4 dok su klase IgG2 i IgG3
slabo zastupljene. Ova antitela fiksiraju komplement, učestvuju u
reakcijama antitelo-posredovane citotoksičnosti i indukuju citotoksične i
destruktivne promene.
Broj epitopa na TPO je različito ocenjen i kreće se od 2-6. Vezivna mesta
za AT su smeštena na hidrofilnim delovima molekule. Kao i u slučaju Tg,
izgleda da su epitopi koje prepoznaju AT konformacioni. UH koji se nalaze
na TPO najverovatnije nisu bitni za vezivanje AT. Neka AT mogu da inhibišu
enzimsku aktivnost TPO. TPOAb su visoko specifična i uprkos sličnosti
nekih sekvenci sa ostalim peroksidazama, nema dokaza ukrštenog reagovanja
sa laktoperoksidazom, peroksidazom iz bubrega i mijeloperoksidazom.
Uobičajeni postupci za određivanje TPOAb su ELISA, Western Blot tehnika i
munofluorescencija na preparatu, a normalno njihov titar iznosi do 1:400.
Povišene vrednosti nalaze se kod 90-100% bolesnika sa Hashimoto
tireoiditisom, 75-100% sa Gravesovom bolešću, prolazno i u manjem stepenu
kod 55-70% bolesnika sa subakutnim tireoiditisom i u manjem procentu kod
boolesnika sa ostalim zapaljenskim i destruktivnim bolestima TŽ (3).
TRAb tj. antitela na TSH receptor određuje se radioreceptorskim testom
koji se zasniva na kompeticiji vezivanja TRAb-a i 125J-TSH, za receptor za
TSH (TBII), a receptorska komponenta sadrži npr. liofilizirane membrane
tirocita svinje prethodno rastvorenih u lubrolu kao kod komercijalnog
TRAK-assay-a, Henning, ili neki drugi izvor TSH-R (masno tkivo, i dr.).
Ovakvim testom dokazuje se postojanje antitela na TSH-R ali se ne testira
u pravom smislu "tiroidna stimulacija", tj. ne može se utvrditi da li su
antitela stimulantna (TSAb) ili blokantna (TSBAb), što se utvrđuje u
raznim biosejima.
Normalne vrednosti TRAb-a dobijenih TRAK-assay-em iznose <15U/L, a
povišena su kod Gravesove bolesti, endokrine eutireoidne oftalmopatije,
istovremenog postojanja Gravesove i Plummer-ove bolesti. Praćenjem nivoa
TRAb-a kod pacijenata na tireosupresivnoj terapiji može se dokazati
"biološka remisija" negativizacijom TRAb-a. Kod pacijenata kod kojih se
održava povišena koncentracija TRAb-a tokom tireosupresivne Th (non
responderi), izgledi za ulazak u trajniju remisiju su mali i treba
razmotriti radikalno lečenje (7, 20-25).
Poslednjih nekoliko godina koristi se druga generacija radioreceptorskog
eseja (RRA) za TRAb koja koristi humani rekombinantni TSH R i čija je senzitivnost
poboljšana u odnosu na prethodni uz očuvanje specifičnosti (26).
D. 2. Određivanje serumske koncentracije tireoglobulina
Smatralo se da je Tg "skriveni" antigen, nepoznat imunom sistemu, ali je
danas poznato da se i normalno u cirkulaciji nalaze male količine (do 50
pmol/L) Tg. Prva tehnika, hemaglutinacija, razvijena je šezdesetih godina
i zamenjena je RIA postupcima početkom sedamdesetih. Pojava monoklonskih
antitela uvela je imunometrijsku metodologiju, pošto RIA ima niz
praktičnih nedostataka, naročito dug period inkubacije i ograničen radni
raspon.
Koncentracija tiroglobulina u serumu prvenstveno odražava veličinu žlezde.
Međutim, svako fizičko oštećenje žlezde (biopsija, operacija, zapaljenje,
oštećenje radiojodom ili stimulacija TSH receptora sa hCG, TSH, TRAb)
dovešće do porasta serumskog Tg nezavisno od promena u tiroidnoj ćelijskoj
masi.
Preoperacijske vrednosti Tg u serumu nemaju dijagnoznu i imaju ograničenu
prognoznu vrednost. Povišen nivo Tg je nespecifičan znak mnogih
neneoplastičnih tiroidnih bolesti, dok se u nekim diferentovanim tiroidnim
karcinomima mogu naći normalne vrednosti Tg u serumu. Najveći značaj
određivanja serumskog nivoa Tg je u postoperativnom praćenju pacijenata
operisanih od diferentovanih karcinoma TŽ.
Normalne vrednosti tireoglobulina u serumu iznose 10-50 ng/ml, a povišene
su kod hipertireoze, kao i kod zapaljenskih stanja i tumora (3). |
|
| |
|
|
| |
|
|
| |
ZAKLJUČAK
Svrha korišćenja testova za ispitivanje tiroidne građe i funkcije je
pravovremeno utvrđivanje dijagnoze bolesti TŽ, kako bi se učinio
odgovarajući izbor lečenja.
Kod ‘morfoloških’ oboljenja TŽ kao što su nodozne i difuzne eutiroidne
strume, ehosonografijom, scintigrafijom i citološkim pregledom aspirata
lezije potrebno je isključiti neoplaziju i radikalni tretman.
Prema Pfannenstiel-u, kod oko 40% svih bolesnika anamneza i klinički nalaz
daju dovoljno podataka o funkcionalnom stanju TŽ, kod 30% bolesnika
potrebno je izvršiti dodatna ispitivanja krvi, kod 25% slučajeva treba
uraditi ispitivanja krvi i neki od dodatnih testova, a kod 5% bolesnika
moguće je postaviti dijagnozu tek na osnovu mnogih ili različitih testova
funkcije TŽ. U svakom slučaju, bez obzira na jasnu anamnezu i klinički
nalaz, dijagnozu treba potvrditi objektivnim laboratorijskim parametrima,
koji su bitni kako za izbor optimalne Th, tako i za njenu kontrolu i
praćenje. Laboratorijske rezultate treba uvek tumačiti u odnosu na
anamnezu i klinički nalaz (19).
Na osnovu prethodno iznetih metoda za testiranje funkcije TŽ, kao
trijažnih metoda za dokazivanje hipertireoidizma kod bolesnika, na prvom
pregledu treba odrediti koncentraciju TSH ultrasenzitivnom metodom (uTSH).
Ukoliko je koncentracija uTSH suprimirana (manje od 0.1 mcU/ml), a
klinički ne postoje jasni znaci hipermetabolizma, testiranje treba
dopuniti određivanjem slobodnih frakcija TH (suprimiran TSH uz normalne
vrednosti slobodnih frakcija TH karakteristika su supkliničke hipertireoze).
Ukoliko je na osnovu suprimiranog TSH i anamnestičkih i kliničkih podataka
postavljena dijagnoza hipertireoze, određivanjem TRAb-a mogu se razlučiti
Gravesova bolest i DTA. Ovo je sa kliničkog stanovišta bitno radi izbora
adekvatne terapije (pacijent sa DTA neće ući u remisiju sa
tireosupresivnom terapijom: izgledi za ulazak u trajniju remisiju
bolesnika "non respondera" su mali). Treba imati na umu da, ukoliko
palpatorno postoji nodus/nodusi u TŽ, treba isključiti i toksični adenom
ili multinodoznu toksičnu strumu scintigrafijom, kao uzrok hipertireoze.
Ukoliko nemamo mogućnost određivanja TRAb-a, tireoidnu patološku
stimulaciju možemo proceniti i kratkim TcU testom. Ako postoji klinička
sumnja da je tireotoksično stanje posledica destrukcije TŽ - painless
tireoidit, niska fiksacija radiojoda ili "blokirana" TŽ na scintigramu
potvrđuju poslednju dijagnozu.
Ukoliko nema mogućnosti za određivanje uTSH i FT3 i FT4, za dijagnozu
hipertireoze može se koristiti TT4 i TT3 ukoliko se isključe stanja sa
poremećajem koncentracije transportnih proteina plazme.
Ostali navedeni testovi tiroidne funkcije mogu se koristiti kao pomoćni
testovi (kada nema drugih mogućnosti za potvrdu dijagnoze) i za praćenje i
kontrolu terapije hipertireoze. |
|
| |
|
|
| |
|
|
| |
LITERATURA
- Wilson JD, Foster DW. The thyroid gland. In: Williams Textbook of
Endocrinology. Saunders Ed. 357-487. Philadelphia 1992.
- Todorović-Đilas Lj, Pantelinac P, Ivković-Lazar T, Kovačev B.
Praktikum iz endokrinologije. Medicinski fakultet Novi Sad, Novi Sad
2000.
- Trbojević B.Tiroidna žlezda. Čip štampa, Beograd, 1998
- Todorović-Đilas Lj. Ultrasonografija i citodijagnostika oboljenja
štitaste žlezde. Medicinski fakultet Novi Sad, Novi Sad 1996.
- Blum M., Passalaqua AM., Sackler J, Pudiowski R. Thyroid echography
of subacute thyroiditis. Radiology. 1977; 124: 795-799.
- Espinasse P. Le'echographie thyroidienne dans les thyroidites
lymphocytaires chroniques autoimmunes. J. Radiol. 1983; 64: 537-544.
- Park HM. The Thyroid gland. in Nuclear Medicine. Henkin RE. Ed.
830-854. Mosby-Year Book, Inc. Saint Louis, 1996
- Jayaran G, Marwaha RK, Gupta RK, Sharma SK. Cytomorphologic aspects
of thyroiditis. A study of 51 cases with functional, immunologic and
ultrasonographic data. Acta Cytol. 1987; 31: 687-693.
- Marcocci C, Vitti P, Cetani F, Catalano F, Concetti R, Pinchera A.
Thyroid Ultrasonography Helps to Identify Patients with Diffuse
Lymphocytic Thyroiditis who Are Prone to Develop Hypothyroidism. J Clin
Endocr and Metabol. 1991; 72: 209 - 213.
- Saleh A, Furst G, Feldkamp J, Godehardt E, Grust A, Modder U.
Estimation of antithyroid drug dose in Graves' disease: value of
quantification of thyroid blood flow with color duplex sonography.
Ultrasound in Medicine & Biology. 2001; 27:1137-41.
- Pfannenstiel P. Dijagnostika oboljenja štitnjače. Tiskarna
Ljubljana, 1975.
- Jayaran G, Marwaha RK, Gupta RK, Sharma SK.: Cytomorphologic aspects
of thyroiditis. A study of 51 cases with functional, immunologic and
ultrasonographic data. Acta Cytol. 1987; 31: 687-693.
- Gutenkust R, Hafermann W, Mansky T, Scriba PC.: Ultrasonography
related to clinical and laboratory findings in lymphocytic thyroiditis.
Acta Endorinol (Copenh). 1989; 121: 129-135.
- Bogazzi F, Bartalena L, Brogioni S, Mazzeo S, Vitti P, Burelli A,
Bartolozzi C, Martino E. Color flow Doppler sonography rapidly
differentiates Type I and II amiodarone-induced thyrotoxicosis. Thyroid
1997; 7: 541-545
- Varsamidis K, Varsamidou E, Mavropoulos G. Doppler ultrasonography
in predicting relapse of hyperthyroidism in Graves’ disease. Acta
Radiologica. 2000; 41: 45-8.
- Saleh A, Furst G, Feldkamp J, Godehardt E, Grust A, Modder U.
Estimation of antithyroid drug dose in Graves' disease: value of
quantification of thyroid blood flow with color duplex sonography.
Ultrasound in Medicine & Biology. 2001; 27: 1137-41.
- Pfannenstiel P. Dijagnostika oboljenja štitnjače. Tiskarna
Ljubljana, 1975.
- Varsamidis K, Varsamidou E, Mavropoulos G. Doppler ultrasonography
in predicting relapse of hyperthyroidism in Graves’ disease. Acta
Radiologica. 2000; 41: 45-8.
- Kasagi K, Tamai H, Morita T. et al. Role of thyrotropin receptor
antibodies in the development of hyperthyroidism: follow-up studies on
nine patients with Graves' disease. J Clin Endocrinol Metab.1989; 68:
1189-94
- De Bruin TWA, Bussemaker JK, Heidema J. et al. Thyrotropin (TSH)
Receptor Modulation by Specific TSH Receptor Antibodies in Graves’
Disease. J Clin Endocrinol Metab. 1988; 67:676-681
- Zakarija M, Garcia A, McKenzie JM. Studies on multiple cell
membrane-directed antibodies in Graves' disease. J Clin Invest. 1985;
76: 1885-91
- Gossage AAR, Crawley JCW, Copping D. et al. Graves' Disease: Thyroid
Function and Immunologic Activity. J Nucl Med 1982; 23 (11): 973-977.
- Wilson R, McKillop JH, Black E. et al. Early prediction of
hypothyroidism following 131I treatment for Graves' disease. Eur J Nucl
Med. 1988; 14: 180-3
- Paunkovic N, Paunkovic J. Diagnostic sensitivity of two radio
receptor assay (TRAK Assay and TRAK Dyno human) for the detection of TSH
receptor antibody.
Nucl Med Rev. 2003; 6: 119-22
|
|
| |
|
|
| |
Adresa autora:
Aleksandar Aleksić
Nikole Pašića 83A 2/2, 19000 Zaječar
e-mail: lukaal@ptt.yu
Rad primljen 10. 08. 2004.
Rad prihvaćen 26. 08. 2004.
Elektronska verzija objavljena 18. 09. 2004. |
|
| |
|
|
|
|
|
|
|
|
|
[ Home ] [ Gore/Up ][ <<< ] [ >>> ]
|
|
|
Infotrend
Crea(c)tive Design |
|
|
|
Revised:
20 May 2009
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|






