| |
|
|
UVOD
Dijabetesna nefropatija (DN) je mikrovaskularna komplikacija
dijabetesa tip 1 i dijabetesa tip 2 i jedan od etioloških faktora
hronične bolesti bubrega (HBB). DN se karakteriše prisustvom
perzistentne albuminurije, hipertezije, retinopatije, progresivnim
padom bubrežne funkcije kao i povećanim rizikom za razvoj
kardiovaskularnih bolesti. Incidenca DN se povećava sa dužinom
trajanja dijabetesa.Veoma mali broj obolelih od dijabetesa razvije
DN u prvih 10 godina trajanja bolesti [1]. Nakon 10-15 godina
stabilne bubrežne funkcije ili hiperfiltracije, u 20-40% pacijenata
sa dijabetesom se javlja mikroalbuminurija [1]. Ukoliko se kod ovih
pacijenata ne bi uvela renoprotektivna terapija, došlo bi do razvoja
manifestne nefropatije koja se karakteriše makro-albuminurijom i
padom jačine glomerularne filtracije (JGF) [1]. Većina bolesnika sa
početnim stadjumom HBB je asimptomatska, te je od velikog značaja da
se što pre indentifikuju takvi pacijenti ne bi li im se obezbedio
odgovarajući tretman u cilju sprečavanja dalje progresije bubrežne
bolesti, ali i redukcije rizika za kardiovaskularne bolesti kojem su
izloženi ovi pacijenti [1]. TBB je povezana sa povećanim
komorbiditetom i mortalitetom, kao i sa visokom cenom terapije
zamene bubrežne funkcije [1].
Patofiziologija DN
DN se odlikuje dugim periodom klinički “neme” faze u toku koje
dolazi do funkcionalnih i strukturnih promena [1]. Funkcionalne
promene su hemodinamske promene u glomerulima i karakterišu se
hiperfiltracijom, hiperperfuzijom i albuminurijom [1].
Hiperfiltracija i hiperperfuzija su najranije promene koje dovode do
razvoja DN. Strukturne promene se odlikuju zadebljanjem glomerularne
i/ili tubularne bazalne membrane i glomerulosklerozom. Funkcionalne
i strukturne promene su međusobno isprepletane jer hiperglikemija
stimuliše sintezu angiotenzina II koji ispoljava hemodinamske,
inflamatorne i profibrogene efekte na bubrežne ćelije [1].
Patogeneza DN
Povećana koncentracija glukoze stimuliše povećanu transkripciju mRNA
za TGF-β1, povećano stvaranje i oslobađanje TGF-β1 u mezangijumskim
ćelijama, kao i povećano stvaranje i oslobađanje proteina
vanćelijskog matriksa (kolagen tip 4, fibronektin, laminin). Sve to
za posledicu ima razvoj glomeruloskleroze i napredovanje dijabetesne
nefropatije [2]. Povećana koncentracija glukoze dovodi i do
glikacije serumskih i tkivnih proteina. Završni proizvodi glikacije
- AGE-P (jedinjenja glukoze i proteina) visoko su reaktivni, vezuju
se za receptore na površini makrofaga, dovode do povećanog stvaranja
i oslobađanja prozapaljenskih medijatora (TNF-α, IL-1, PDGF i
IGF-1), koji stimulišu u mezangijumske ćelije da pojačano stvaraju
proteine vanće-lijskog matriksa, što dodatno pospešuje razvoj
glomeruloskleroze [2].
Povećana koncentracija glukoze, poliola (sorbitola) i proizvoda
glikacije, ne oštećuje samo glomerul nego i tubulointersticijum,
shema 1 [2-4].
Dijabetesna nefropatija nastaje kao posledica složenih interakcija
između glomerula, tubula, intersticijuma i vaskularnih struktura
bubrega [4]. Između epitelnih ćelija proksimalnih tubula i
fibroblasta intersticijuma, u uslovima hiperglikemije i
proteinurije, postoje mnogobrojne interakcije koje uključuju
vazoaktivne peptide (angiotenzin 2, ET-1), puteve koji zavise od
glukoze, kao što je poliolski put metabolizma glukoze (povećano
stvaranje sorbitola), završne proizvode glikacije - AGEs, citokine i
transformišući faktor rasta - TGFβ1 [4]. Oslobođeni medijatori
dovode do infiltracije intersticijuma monocitima/makrofagima i
ožiljavanja tubulointersticijuma [4-7].
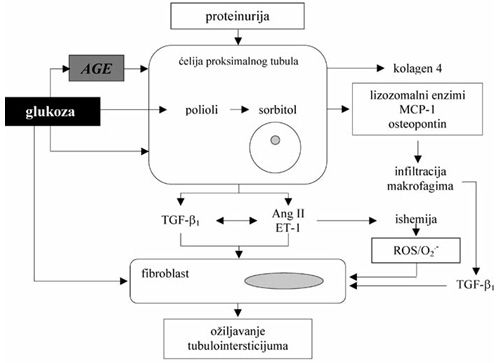
Shema 1. Mehanizmi oštećenja tubulointersticijuma kod bolesnika s
DN[8]
Klinički tok DN
DN prolazi kroz pet stadijuma: stadijum hemodinamskih promena,
stadijum strukturnih promena, stadijum incipijentne DN, stadijum
klinički manifestne DN i završni stadijum oštećenja bubrega [8].
Početni stadijumi DN (stadijum I i II) uglavnom su asimptomatski i
odlikuju se funkcionalnim ili strukturnim promenama bubrega uz
moguću pojavu arterijske hipertenzije. Nivo azotnih materija (ureja
i kreatinin) u ovim stadijumima su u granicama referentnih
vrednosti. Stadijum incipijentne DN se odlikuje pojavom albuminurije
30-300mg/24h koja se javlja 10-15 godina od početka dijabetesa [8].
Stadijum klinički manifestne nefro-patije se odlikuje
makroalbuminurijom > 300mg/24h, odnosno proteinurijom >500mg
/24h[8].
U odmaklijim stadijumima DN dolazi do pojave azotemije koja se
pogoršava sa padom JGF, zatim dolazi do promena u laboratorijskim
parametrima, što ukazuje na disfunkciju i u drugim organskim
sistemima. Na kraju bubrežna bolest progredira do terminalnog
stadijuma koji zahteva dijalizni tretman ili transplantaciju
bubrega. Dijabetesna nefropatija je najčešći uzrok TBB.
Kod makroalbuminurije (> 300 mg/24h) ili proteinurije (> 500
mg/24h), stepen opadanja jačine glomerulske filtracije kod nelečenih
bolesnika s tipom 1 i tipom 2 šećerne bolesti iznosi 10-12
ml/min/1,73m2 godišnje [8].
Tabela 1. Stadijumi DN (modifikovana tabela iz literature(1))
| Stadijumi DN |
JGF (mL/min./1,73m2) |
Stepen albuminurije |
| 0 Faktori rizika za HBB |
> 90 |
Normoalbuminurija |
| I Stadijum hemodinamskih promena(hiperfiltracija) |
< 90 |
Normoalbuminurija |
| II Stadijum strukturnih promena |
60-89 |
Normoalbuminurija |
| III Stadijum incipijentne DN |
30-59 |
Mikroalbuminurija
(30-300mg/24h) |
| IV Stadijum klinički manifestne DN |
15-29 |
Makroalbuminurija (>300mg/24h) |
| V Završni stadijum oštećenja bubrega |
<15 |
|
Tabela 2. Klinički parametri DN(1)
| Incipijentna DN |
Klinički manifestna nefropatija |
Terminalna bubreţna insuficijencija |
| ↑ JGF, nefromegalija, mikroalbuminurija
|
Proteinurija >500 mg/dan,
HTA, ↓ JGF, retinopatija |
- |
Koje terapijske mere preveniraju dijabetesnu nefropatiju?
Kontrola glikemije
S obzirom na to da je dijabetes melitus sve češći uzrok pojave DN,
kao bubrežne bolesti koja vodi u TBB, to je kontrola glikemije kod
ovih pacijenata veoma bitna za prevenciju DN. Dobra kontrola
glikemije i njeni efekti na razvoj nefropatije se prate promenama u
nivou glikemije i vrednosti HbA1c (glikoliziranog hemoglobina).
Primena metformina udružena je sa smanjenjem rizika razvoja i
progresije dijabetesne nefropatije. Međutim, metformin ne treba
koristiti kod bolesnika s oštećenom funkcijom bubrega (kreatinina u
serumu ≥133 mmol/l kod muškaraca i ≥124 mmol/l kod žena), ili kod
bolesnika sa smanjenim klirensom endogenog kreatinina (JGF < 60
ml/min/1,73m2), zbog rizika od laktične acidoze [9, 10, 11].
Intenzivirana insulinska terapija (IIT-PEN, insulinska pumpa), kod
bolesnika koji boluju od dijabetesa tip 1 i tip 2, omogućava bolju
glikoregulaciju (glikozilirani hemoglobin-HbA1c <7%) i smanjuje
rizik za razvoj i progresiju dijabetesne nefropatije, tabela 3 [11,
12].
Nekoliko kontrolisanih randomiziranih studija je pokazalo da
intenzivna kontrola glikemije znatno smanjuje rizik od razvoja
mikroalbuminurije, makroalbuminurije i/ili nefropatije kod
pacijenata sa dijabitesom tip1 [14, 15] i tip 2 [10, 13]. Na osnovu
ovih studija CARI (The Caring for Australians with Renal
Insufficiency) smernice preporučuju da vrednost ciljanog PPG
(preprandijalna glukoza) bude između 4,4-6,7mmol/L a HbA1c≤7% za sve
pacijente sa dijabetesom [16]. Međutim, trenutno nema dokaza da
glikoregulacija menja ishod već razvijene nefropatije.
Smanjenje arterijskog pritiska
Mnoge kontrolisane randomizirane studije su pokazale da je smanjenje
arterijskog pritiska povezano sa značajnim smanjenjem JGF (1,1-6,2
mL/min godišnje) kod dijabetičara [22-30] i nedijabetičara [17-21]
sa TBB. Regresivne meta analize su potvrdile da je svako smanjenje
arterijskog pritiska za 10 mm Hg dobrobit za očuvanje JGF od 3,7
-5,0 mL/min godišnje. Stepen očuvanja bubrežne funkcije uslovljen
smanjenjem arterijskog prit-iska je proporcionalan stepenu
proteinurije, pa je njegovo smanjenje sledeći korak u lečenju [21,
32, 33].
U multicentričnoj studiji ,,Modifikacija dijete u bolestima bubrega”
pokazana je razlika u padu srednje vrednosti JGF između grupa
pacijenata sa niskim i normalnim arterijskim pritiskom. Najveće
smanjenje vrednosti JGF je bilo među pacijentima sa proteinurijom
>3g/dan (približno 4 mL/min godišnje), srednje među pacijentima sa
proteinurijom 1-3 g/dan (približno 2 mL/min godišnje) i najmanje
među pacijentima sa proteinurijom <1g/dan (0 mL/min godišnje) [32].
Štaviše, svako smanjenje proteinurije za 1 mg/dan praćeno upotrebom
antihipertenzivne terapije je bilo povezano sa smanjenjem JGF za
0,9-1,3 mL/min godišnje [32]. Da bi se postigle ciljane vrednosti
arterijskog pritiska potrebno je u terapiju uvesti 3-4
antihipertenzivna leka.
Ujedinjeni Nacionalni komitet je preporučio da ciljani arterijski
pritisak kod pacijenata sa dijabetesom i HBB bude ispod 130/85 mmHg,
a po smernicama Svetske zdravstvene organizacije vrednosti ciljanog
arterijskog pritiska kod pacijenata sa proteinurijom >1g/24h moraju
biti ispod 125/75 mm Hg [34].Praktična primena ovih smernica
prikazana je u shemi 2.
Shema 2.Vodič za postizanje cijane vrednosti arterijskog pritiska
kod pacijenata sa HBB i/ili DN
Arterijski pritisak>130/80mmHg
↓
Početi sa ACE inhibitorima i/ili ARA
↓
Ako nije postignuta ciljana vrednst arterijskog pritiska (130/85)
↓
Dodati Tiazidne diuretike ili Blokatore kalcijumskih kanala
↓
I dalje nije postignuta ciljana vrednst arterijskog pritiska
(130/85)
↓
Dodati malu dozu Beta blokatora(puls>84) ili drugi iz grupe
Blokatora kalcijumskih kanala(puls<84)
↓
Ako nije postignuta ciljana vrednst arterijskog pritiska
↓
Uputiti pacijenta specijalisti
ACE inhibitori
ACE inhibitori su pokazali da usporavaju progresiju TBB kod
dijabetičara [25-27, 41-50] i ne dijabetičara [19, 21, 33, 35-40] i
kao efikasnija terapija u odnosu na β- blokatore, diuretike i
blokatore kalcijumskih kanala [50, 51]. Smanjenje relativnog rizika
za razvoj TBB upotrebom ACE inhibitora se kreće od 30-50 %. Iako
nije bilo međusobnih poređenja, nema dokaza da bilo koji ACE
inhibitor ima prednost u odnosu na druge iz grupe.
Utvrđeno je da ACE inhibitori obezbeđuju renoprotekciju i kod
početno povišene proteinurije, čak i one >3 g/dan [33]. Stepen
renoprotekcije ACE inhibitorima veći je i kod pacijenata sa težim
oštećenjem bubrega kao i kod onih koji imaju porast serumskog
kreatinina na početku lečenja [17, 25, 31, 52]. Zato je važno da se
ACE inhibitori ne povlače iz terapije pacijenata sa TBB, čak iako
dođe do akutnog porasta serumskog kreatinina za 30 % [31]. On se
stabilizuje tokom 2 meseca terapije ACE inhibitorima zbog čega ovi
pacijenti imaju i najveću dobrobit od terapije ACE inhibitorima
[31]. Štaviše, nekoliko studija je potvrdilo da je rast serumskog
kreatinina reverzibilan kod pacijenata koji su na terapiji ACE
inhibitorima čak i nakon 6 godina po prestanku lečenja [53]. Ako je
rast serumskog kreatinina iznad 30% od početne vrednosti, ACE
inhibitore bi trebalo povući iz terapije i razmotriti mogućnost
postojanja bilateralne stenoze renalnih arterija [31]. ACE
inhibitore takođe, treba povući iz terapije ukoliko je kalijum >6
mmol/l uprkos redukcionoj dijeti, smanjenju unosa kalijuma i
istovremenoj terapiji diureticima. Učestalost ove komplikacije kod
pacijenata sa TBB je 2% sa prosečnim rastom serumskog kalijuma od
0,5 mmol/l.
Treba napomenuti da je studija o efikasnosti ramiprila u nefropatiji
pokazala da je pad JGF dvostruko brži kod pacijenata sa dijabetesom
tip 2 nego u placebo kontrolisanoj studiji [33].
Antagonisti receptora za angiotenzin (ARA)
Za razliku od studija o ACE inhibitorima, postoje 3 kontrolisane
randomizirane studije o ARA kod pacijenata sa DN dijabetesa tip
[22-24]. Ova istraživanja su pokazala da ARA značajno smanjuje
prelazak mikro u makroalbuminuriju i progresiju DN u TBB.
Pet randomiziranih uporednih studija je pokazalo da je kombinovana
terapija ACE inhibitorima i ARA kod normo ili hipertenzivnih
pacijenata sa HBB postigla i antihipertenzivni i antiproteinurijski
efekat u poređenju sa drugim lekovima [54-58]. Ova studija je takođe
pokazala bolju kontrolu arterijskog pritiska kod dijabetesa tip 2
upotrebom kombinovane terapije, ali nije ragistrovala bilo kakvu
zna-čajnu promenu mikroalbuminurije zbog relativno kratkog vremena
praćenja [59]. Učestalost neže-ljenih efekata upotrebom kombinovane
terapije ACE i ARA, kao što je hiperkalijemija, slična je kao kod
monoterapije ARA.
Blokatori kalcijumskih kanala
Nema mnogo studija o uticaju blokatora kalcijumskih kanala za
razliku od studija o ACE inhibitorima i ARA na osnovu kojih bi se
moglo za-ključiti da je renoprotektivni efekat ispred
antihipertenzivnog efekta.
Dve male ali značajne kontrolisane randomizirane studije o uticaju
Verapamila i/ili Diltiazema na DN su pokazale da usporavaju
progresiju TBB slično kao i ACE inhibitori [60], a superiornije u
odnosu na β-blokatore [59]. Štaviše, studija o DN je pokazala da
Amlodipin ima manji efekat na smanjenje progresije DN kod dijabetesa
tip 2 u odnosu na Ibersartan [22]. U kontrolisanoj randomiziranoj
studiji koja je obuhvatila 37 dijabetičara, dodavanje blokatora
kalcijumskih kanala ACE inhibitorima pokazalo je superioran
antiproteinurijski efekat u poređenju sa monoterapijom ACE
inhibitorima iako nije bilo razlike u padu JGF tokom jedne godine
praćenja [61].
Na osnovu gore pomenutih studija može se zaključiti da bi blokatore
kalcijumskih kanala trebalo koristiti kao lekove druge linije u
prevenciji progresije TBB.
Lečenje hiperlipidemije
Meta analiza jedanaest kontrolisanih randomiziranih studija i dve
uporedne randomizirane studije je pokazala da je snižavanje
lipoproteina (većinom su pacijenti bili na terapiji statinima sa
približnim brojem na nikotinatu) povezano sa značajnim padom
proteinurije i smanjenjem JGF od 1,44 mL/min godišnje kod pacijenata
sa TBB [62]. Iako je ukupan broj pacijenata bio mali, ne mogu se
zanemariti rezultati objedinjenih studija o antiproteinurijskom
efektu i njegovom statističkom značaju.
Najnovija kontrolisana randomizirana studija koja je obuhvatila 56
pacijenata sa HBB na atorvastatinu je pokazala značajan
antiproteinurijski efekat i usporavanje rasta klirens kreatinina
tokom jedne go-dine [63]. Renoprotektivni efekti ACE inhibitora i
ARA se pojačavaju dodavanjem atorvastatina [63].
Kod pacijenata sa DN koji imaju povećanu koncentraciju ukupnog i LDL
holesterola dolazi do ubrzanog gubitka bubrežne funkcije[64]. Nivo
LDL holesterola kod bolesnika s dijabetesnom nefropatijom treba da
iznosi < 3,4 mmol/l, nivo HDL holesterola > 1,3 mmol/l (idealno >
1,5 mmol/l), nivo ukupnog holesterola < 5,2 mmol/l , a triglicerida
< 1,7 mmol/l [64]. Kod bolesnika s visokim rizikom (dijabetes
melitus, hronična slabost bubrega) ili kod bolesnika s koronarnom
bolešću srca, prema ETF (European Task Force) ciljni nivo LDL
holesterola treba da bude 3 mmol/l, a prema NCEP (National
Cholesterol Education Program) smernicama 2,6 mmol/l (Tabela
3)[65-68].
Restriktivna proteinska dijeta
Veza između restriktivne proteinske dijete i TBB je proučavana na
četiri meta analize, ali samo dve kontrolisane randomizirane studije
su pokazale da redukcija proteina u ishrani ima statistički i
klinički značajan efekat na smanjenje telesne težine i biohemijske
parametre [69-72].
Ovaj režim ishrane podrazumeva smanjeni unos belančevina
životinjskog porekla, od 0,5 do 0,8 g/kg TT/24 h, u odnosu na
normalni unos koji iznosi od 1,0 do 1,2 g/kg TT/24 h[69], tabela
3.To podrazumeva i adekvatnu nadoknadu esencijalnih amino kiselina
radi sprčavanja eventualne malnutricije u ovih bolesnika. Ovakva
redukcija belančevina u ishrani značajno usporava gubitak preostalih
nefrona, posebno u odmakloj HBB, kada je JGF<25 ml/min[69].
Iz ovog razloga CARI smernice preporučuju redukciju unosa proteina
za usporenje progresije TBB [16].
Eritropoetin(EPO)
Primena EPO u lečenju renalne anemije je značajno uticala na
korekciju anemijskog sindroma, pojavu komorbidnih stanja i
rehabilitacija u pacijenata sa HBB. Efekti primene EPO u dijaliznih
pacijenata su dobro poznati i dugo izučavani. Kada je primena EPO
kod predijaliznih pacijenata u pitanju, neophodno je jasno
definisati nekoliko pojmova:
- ciljne vrednosti hemoglobina (Hb) i hematokrita (Ht),
- vreme otpočinjanja lečenja,
- doza i način primene leka.
Termin „ciljni“ označava one vrednosti Hb i Ht koje, kada se
postignu, imaju najveću korist za pacijenta, sa najmanje štetnih
efekata. Na osnovu opšte prihvaćenih DOQI smernica [73], vrednost Ht
od 0,33 do 0,36 i Hb od 11g/dl do 12g/dl predstavljaju ciljane
vrednosti (Tabela 3).
Terapiju EPO započeti kada je vrednost Hb ispod 11g/dl a Ht<33%[74].
Doziranje i način primene EPO su jako značajni za uspeh terapije. Na
osnovu DOQI preporuka, EPO se daje supkutano. Kod pacijenata sa
adekvatnom rezervom gvožđa i bez znakova infekcije uobičajeno se
daje od 80 do 120 IU/kg TT nedeljno, podeljeno u 2-3 doze [73].
Efekti se prate mesečno a očekivani porast Hb bi trebalo da bude 1
do 2g/dl/ mesečno [73].
Prestanak pušenja
Velika nasumična kontrolisana studija je pokazala da je pušenje
nezavistan faktor rizika za tešku proteinuriju i klinički značajno
propadanje funkcije bubrega [75]. Bivši pušači nisu bili u povećanom
riziku dokazujući tako da je prestanak pušenja povezan sa smanjenjem
rizika za progresiju bubrežne bolesti [75].
U retrospektivnim studijama na dijabetičarima pokazano je da pušenje
povećava rizik od mikroalbuminurije [76] skraćujući vremenski
interval od početka dijabetesa do pojave albuminurije [77]
ubrzavajući progresiju DN u TBB [77]. Prestanak pušenja je u vezi sa
smanjenjem proteinurije i progresije DN kod dijabetičara.
Tabela 3.Faktori rizika za progresiju DN i prevencija progresije DN
(modifikovana tabela iz lit. (2))
| Faktori rizika za progresiju DN |
Prevencija (ciljevi) |
| Arterijski pritisak |
Arterijski pritisak <130/80mmHg |
| Blokada sistema rennin -angiotenzin |
Proteinurija<0,5g/24h |
| Hiperlipidemija |
LDL holesterol <2,6mmol/l |
| Hipetglikemija |
HbAc<7% |
| Unos proteina |
Hipoproteiska dijeta 0,8g/kg/dan |
| Anemija |
Hemoglobin =11-12g/dl |
ZAKLJUČAK
Raspoloživi dokazi ukazuju da je TBB čest, potcenjen i teško
rešiv problem. Najvažniji cilj kod pacijenata sa TBB je redukcija
arterijskog pritiska do ciljanih vrednosti (<130/85 mmHg, ako je
proteinurija < 1g/dan ili 125/75mmHg, ako je proteinurija >1g/dan).
Na osnovu do sada prikupljenih dokaza, ACE inhibitori ostaju lekovi
prve linije iako noviji dokazi potvrđuju da i ARA mogu imati
renoprotektivni efekat na DN kod dijabetesa tip 2. U cilju
postizanja preporučenih vrednosti arterijskog pritiska potrebno je u
terapiju uvesti nekoliko antihipertenzivnih lekova (obično 3-4).
Kombinacija ACE inhibitora ili ARA sa blokatorima kalcijumskih
kanala obezbeđuje bolji terapijski efekat.
Strategije koje su se takođe pokazale kao efikasne su upotreba
statina, prestanak pušenja, korekcija bubrežne anemije
eritropoetinom, edukacija pacijenata.Kontrola glikemije je efikasna
primarna prevencija u dijabetesu tip 2, ali ostaje da se pokaže
njena efikasnost u sekundarnoj prevenciji. Restriktivna proteinska
dijeta daje skroman doprinos u lečenju TBB, zbog loših navika u
ishrani.
Činjenica je da se bubrežna funkcija može očuvati ako se
renoprotektivna terapija upotrebi u ranom stadijumu bolesti, iako
su, na žalost, mnoge poznate komplikacije prisutne u ranom stadijumu
bubrežne bolesti. Pacijenti sa DN zahtevaju veći broj
hospitalizacija i poseta lekaru godišnje, što svakako po-većava
troškove lečenja.
LITERATURA
- Čabarkapa V. Odnos specifičnih biomarkera i progresija HBB u
bolesnika sa dijabetesnom nefropatijom [doktorska disertacija].
Medicinski fakultet u Novom Sadu,2011.
- Schleicher E, kolm V, Ceol M, Nerlich A.Structural and
Functional Changes in Diabetic Glomerulopathy. kidney Blood
Press Res 1996; 19 (5): 305-15.
- Hamada Y, Araki N, Horiuchi S, Hotta N. Role of polyol
pathway in nonenzymatic glication. Nephrol Dial Transplant 1996;
11Suppl 5: 95-8.
- Gilbert ER, Cooper EM. The tubulointerstitium in progressive
diabetic kidney disease: More than an aftermath of glomerular
injury? Kidney Int 1999; 56(4): 1627-37.
- Phillips AO. Janssen U, Floege J. Progression of Diabetic
Nephropathy. Kidney Blood Press Res 1999; 22 (1-2): 81-97.
- Ruggenenti P, Remuzzi G. Nephropathy of type 1 and type 2
diabetes: diverse pathophysiology, same treatment? Nephrol Dial
Transplant 2000; 15 (12): 1900-2.
- Salahudeen Ak, kanji V, Reckelhoff JF, Schmidt AM.
Pathogenesis of diabetic nepropathy: a radical approach. Nephrol
Dial Transplant 1997; 12 (4): 664-8.
- Petrović D, Nikolić A, Stojimirović B. Klinički značaj
faktora rizika u sprečavanju progresije dijabetesne nefropatije.
Pons 2011;26:19-25.
- Remuzzi G, Schieppati A, Ruggenenti P. Nephropathy in
Patients with Type 2 Diabetes. N Engl J Med 2002; 346 (15):
1145-51.
- UK Prospective Diabetes Study (UKPDS) Group. Intensive
blood-glucose control with sulphonylureas or insulin compared
with conventional treatment and risk of complications in
patients with type 2 diabetes (UKPDS 33). Lancet 1998; 352:
837–53.
- Haneda M, Morikawa A. Wich hypoglicaemic agents to use in
type 2 diabetic subjects with CkD and how? Nephrol Dial
Transplant 2009; 24 (2): 338-41.
- Manske CL. Hyperglycemia and Intensive Glycemic Control in
Diabetic Patients With Chronic Renal Disease. Am J kidney Dis
1998; 32(5 Suppl 3): 157-71.
- Ohkubo Y, Kishikawa H, Araki E, Miyata T, Isami S, Motoyoshi
S et al. Intensive insulin therapy prevents the progression of
diabetic microvascular complications in Japanese patients with
non-insulin-dependent diabetes mellitus: a randomized
prospective 6-year study. Diabetes Res Clin Pract 1995; 28:
103–17.
- The Diabetes Control and Complications Trial/Epidemiology of
Diabetes Interventions and Complications Research Group.
Retinopathy and nephropathy in patients with type 1 diabetes
four years after a trial of intensive therapy. N Engl J Med
2000; 342: 381–9.
- Barbosa J, Steffes MW, Sutherland DE, Connett JE, Rao KV,
Mauer SM. Effect of glycemic control on early diabetic renal
lesions. A 5-year randomized controlled clinical trial of
insulindependent diabetic kidney transplant recipients. JAMA
1994; 272: 600–6.
- Harris DCH, Johnson DW, Matthews T, Thomas M, Nichols K,
Nankivell B et al. The Caring for Australians with Renal
Insufficiency (CARI) guidelines. Part 2 – Early kidney disease
guidelines: prevention of progression of kidney disease.
Adelaide: Australian Kidney Foundation and Australian and New
Zealand Society of Nephrology [cited 29 May 2002]. Available
from: URL:
http://www.kidney.org.au/cari/drafts/new/prevention.html
- Klahr S, Breyer JA, Beck GJ, Dennis VW, Hartman JA, Roth D
et al. Dietary protein restriction, blood pressure control, and
the progression of polycystic kidney disease. Modification of
Diet in Renal Disease Study Group. J Am Soc Nephrol 1995;
5:2037–47.
- Gansevoort RT, Sluiter WJ, Hemmelder MH, de Zeeuw D, de Jong
PE. Antiproteinuric effect of blood-pressure-lowering agents: a
meta-analysis of comparative trials. Nephrol Dial Transplant
1995; 10: 1963–74.
- Giatras I, Lau J, Levey AS. Effect of angiotensin-converting
enzyme inhibitors on the progression of nondiabetic renal
disease: a meta-analysis of randomized trials.
Angiotensin-Converting-Enzyme Inhibition and Progressive Renal
Disease Study Group. Ann Intern Med 1997; 127: 337–45.
- Hebert LA, Kusek JW, Greene T, Agodoa LY, Jones CA, Levey AS
et al. Effects of blood pressure control on progressive renal
disease in blacks and whites. Modification of Diet in Renal
Disease Study Group. Hypertension 1997; 30: 428–35.
- GISEN Group. Randomised placebo-controlled trial of effect
of ramipril on decline in glomerular filtration rate and risk of
terminal renal failure in proteinuric, non-diabetic nephropathy.
The GISEN Group (Gruppo Italiano di Studi Epidemiologici in
Nefrologia). Lancet 1997; 349: 1857–63.
- Lewis EJ, Hunsicker LG, Clarke WR, Berl T, Pohl MA, Lewis JB
et al. Renoprotective effect of the angiotensin-receptor
antagonist irbesartan in patients with nephropathy due to type 2
diabetes. N Engl J Med 2001; 345: 851–60.
- Brenner BM, Cooper ME, de Zeeuw D, Keane WF, Mitch WE,
Parving HH et al. Effects of losartan on renal and
cardiovascular outcomes in patients with type 2 diabetes and
nephropathy. N Engl J Med 2001; 345: 861–9.
- Parving HH, Lehnert H, Brochner-Mortensen J, Gomis R,
Andersen S, Arner P. The effect of irbesartan on the development
of diabetic nephropathy in patients with type 2 diabetes. N Engl
J Med 2001; 345: 870–78.
- Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. The effect of
angiotensin-converting-enzyme inhibition on diabetic
nephropathy. The Collaborative Study Group. N Engl J Med 1993;
329: 1456–62.
- Weidmann P, Boehlen LM, de Courten M. Effects of different
antihypertensive drugs on human diabetic proteinuria. Nephrol
Dial Transplant 1993; 8: 582–4.
- Weidmann P, Schneider M, Bohlen L. Therapeutic efficacy of
different antihypertensive drugs in human diabetic nephropathy:
an updated meta-analysis. Nephrol Dial Transplant 1995; 10 Suppl
9: 39–45.
- Lewis JB, Berl T, Bain RP, Rohde RD, Lewis EJ. Effect of
intensive blood pressure control on the course of type 1
diabetic nephropathy. Collaborative Study Group. Am J Kidney Dis
1999; 34: 809–17.
- Estacio RO, Jeffers BW, Gifford N, Schrier RW. Effect of
blood pressure control on diabetic microvascular complications
in patients with hypertension and type 2 diabetes. Diabetes Care
2000; 23 Suppl 2: B54–64.
- Crepaldi G, Carta Q, Deferrari G, Mangili R, Navalesi R,
Santeusanio F et al. Effects of lisinopril and nifedipine on the
progression to overt albuminuria in IDDM patients with incipient
nephropathy and normal blood pressure. The Italian
Microalbuminuria Study Group in IDDM. Diabetes Care 1998; 21:
104–10.
- Bakris GL,Weir MR. Angiotensin-converting enzyme
inhibitorassociated elevations in serum creatinine: is this a
cause for concern? Arch Intern Med 2000; 160: 685–93.
- Klahr S, Levey AS, Beck GJ, Caggiula AW, Hunsicker L, Kusek
JW et al. The effects of dietary protein restriction and
bloodpressure control on the progression of chronic renal
disease. Modification of Diet in Renal Disease Study Group. N
Engl J Med 1994; 330: 877–84.
- Ruggenenti P, Perna A, Gherardi G, Gaspari F, Benini R,
Remuzzi G. Renal function and requirement for dialysis in
chronic nephropathy patients on long-term ramipril: REIN
follow-up trial. Gruppo Italiano di Studi Epidemiologici in
Nefrologia (GISEN). Ramipril Efficacy in Nephropathy. Lancet
1998; 352: 1252–56.
- The Fifth Report of the Joint National Committee on
Detection, Evaluation, and Treatment of High Blood Pressure (JNC
V). Arch Intern Med 1993;153:154-83.
- Zucchelli P, Gaggi R, Zuccala A. Angiotensin converting
enzyme inhibitors and calcium antagonists in the progression of
renal insufficiency. Contrib Nephrol 1992; 98: 116–24.
- Kamper AL, Strandgaard S, Leyssac PP. Effect of enalapril on
the progression of chronic renal failure. A randomized
controlled trial. Am J Hypertens 1992; 5: 423–30.
- Hannedouche T, Landais P, Goldfarb B, el Esper N, Fournier
A, Godin M et al. Randomised controlled trial of enalapril and
beta blockers in non-diabetic chronic renal failure. BMJ 1994;
309: 833–7.
- Himmelmann A, Hansson L, Hansson BG, Hedstrand H, Skogstrom
K, Ohrvik J et al. ACE inhibition preserves renal function
better than beta-blockade in the treatment of essential
hypertension. Blood Press 1995; 4: 85–90.
- Ihle BU, Whitworth JA, Shahinfar S, Cnaan A, Kincaid-Smith
PS, Becker GJ. Angiotensin-converting enzyme inhibition in
nondiabetic progressive renal insufficiency: a controlled
doubleblind trial. Am J Kidney Dis 1996; 27: 489–95.
- Maschio G, Alberti D, Janin G, Locatelli F, Mann JF,
Motolese M et al. Effect of the angiotensin-converting-enzyme
inhibitor benazepril on the progression of chronic renal
insufficiency.The Angiotensin-Converting-Enzyme Inhibition in
Progressive Renal Insufficiency Study Group. N Engl J Med 1996;
334: 939–45.
- Heart Outcomes Prevention Evaluation Study Investigators.
Effects of ramipril on cardiovascular and microvascular outcomes
in people with diabetes mellitus: results of the HOPE study and
MICRO-HOPE substudy. Heart Outcomes Prevention Evaluation Study
Investigators. Lancet 2000; 355: 253–9.
- Lovell HG, ed. Are angiotensin converting enzyme inhibitors
useful for normotensive diabetic patients with microalbuminuria?
Oxford: Cochrane Database Syst Rev 2000; (2): CD002183. Update
in: Cochrane Database Syst Rev 2001; (1): CD002183.
- Marre M, Chatellier G, Leblanc H, Guyene TT,Menard J, Passa
P. Prevention of diabetic nephropathy with enalapril in
normotensive diabetics with microalbuminuria. BMJ 1988; 297:
1092–5.
- Bilo H, Kluitman E, van Ballegooie E, Potter van Loon BJ,
Bakker K, Michels B et al. Long term use of captopril or
nifedipine in normotensive microalbuminuric patients with
insulin-dependent diabetes mellitus. Diabetes Res 1993;
23:115–22.
- Chase HP, Garg SK, Harris S, Hoops S, Jackson WE, Holmes DL.
Angiotensin-converting enzyme inhibitor treatment for young
normotensive diabetic subjects: a two-year trial. Ann Ophthalmol
1993; 25: 284–9.
- Hallab M, Gallois Y, Chatellier G, Rohmer V, Fressinaud P,
Marre M. Comparison of reduction in microalbuminuria by
enalapril and hydrochlorothiazide in normotensive patients with
insulin dependent diabetes. BMJ 1993; 306: 175–82.
- Mathiesen ER, Hommel E, Giese J, Parving HH. Efficacy of
captopril in postponing nephropathy in normotensive insulin
dependent diabetic patients with microalbuminuria. BMJ 1991;
303: 81–7.
- Parving HH, Hommel E, Damkjaer NM, Giese J. Effect of
captopril on blood pressure and kidney function in normotensive
insulin dependent diabetics with nephropathy. BMJ 1989;
299:533–6.
- Agardh CD, Garcia-Puig J, Charbonnel B, Angelkort B, Barnett
AH. Greater reduction of urinary albumin excretion in
hypertensive type II diabetic patients with incipient
nephropathy by lisinopril than by nifedipine. J Hum Hypertens
1996;10:185–92.
- Lebovitz HE, Wiegmann TB, Cnaan A, Shahinfar S, Sica DA,
Broadstone V et al. Renal protective effects of enalapril in
hypertensive NIDDM: role of baseline albuminuria. Kidney Int
Suppl 1994; 45: S150–55.
- Nielsen FS, Rossing P, Gall MA, Skott P, Smidt UM, Parving
HH. Long-term effect of lisinopril and atenolol on kidney
function in hypertensive NIDDM subjects with diabetic
nephropathy. Diabetes 1997; 46: 1182–8.
- Hansen HP, Rossing P, Tarnow L, Nielsen FS, Jensen BR,
Parving HH. Increased glomerular filtration rate after
withdrawal of long-term antihypertensive treatment in diabetic
nephropathy. Kidney Int 1995; 47: 1726–31.
- Russo D, Pisani A, Balletta MM, De Nicola L, Savino FA,
Andreucci M et al. Additive antiproteinuric effect of converting
enzyme inhibitor and losartan in normotensive patients with IgA
nephropathy. Am J Kidney Dis 1999; 33: 851–6.
- Kincaid-Smith P, Fairley K, Packham D. Randomized controlled
crossover study of the effect on proteinuria and blood pressure
of adding an angiotensin II receptor antagonist to an
angiotensin converting enzyme inhibitor in normotensive patients
with chronic renal disease and proteinuria. Nephrol Dial
Transplant 2002; 17: 597–601.
- Jacobsen P, Andersen S, Rossing K, Hansen BV, Parving HH.
Dual blockade of the renin-angiotensin system in type 1 patients
with diabetic nephropathy. Nephrol Dial Transplant 2002; 17:
1019–24.
- Jacobsen P, Andersen S, Rossing K, Jensen BR, Parving HH.
Dual blockade of the renin-angiotensin system versus maximal
recommended dose of ACE inhibition in diabetic nephropathy.
Kidney Int 2003; 63: 1874–80.
- Rossing K, Christensen PK, Jensen BR, Parving HH. Dual
blockade of the renin-angiotensin system in diabetic
nephropathy: a randomized double-blind crossover study. Diabetes
Care 2002; 25: 95–100.
- Mogensen CE, Neldam S, Tikkanen I, Oren S, Viskoper R, Watts
RW et al. Randomised controlled trial of dual blockade of
renin-angiotensin system in patients with hypertension,
microalbuminuria, and non-insulin dependent diabetes: the
candesartan and lisinopril microalbuminuria (CALM) study. BMJ
2000; 321: 1440–44.
- Bakris GL, Copley JB, Vicknair N, Sadler R, Leurgans S.
Calcium channel blockers versus other antihypertensive therapies
on progression of NIDDM associated nephropathy. Kidney Int 1996;
50: 1641–50.
- Bakris GL, Mangrum A, Copley JB, Vicknair N, Sadler R.
Effect of calcium channel or beta-blockade on the progression of
diabetic nephropathy in African Americans. Hypertension 1997;
29: 744–50.
- Bakris GL,Weir MR, DeQuattro V, McMahon FG. Effects of an
ACE inhibitor/calcium antagonist combination on proteinuria in
diabetic nephropathy. Kidney Int 1998; 54: 1283–9.
- Fried LF, Orchard TJ, Kasiske BL. Effect of lipid reduction
on the progression of renal disease: a meta-analysis. Kidney Int
2001; 59: 260–69.
- Bianchi S, Bigazzi R, Caiazza A, Campese VM. A controlled,
prospective study of the effects of atorvastatin on proteinuria
and progression of kidney disease. Am J Kidney Dis 2003;
41:565–70.
- Oda H, keane FW. Lipids in progression of renal disease.
kidney Int 1997; 52 Suppl 62: 36-8.
- Wanner C. Importance of hyperlipidaemia andtherapy in renal
patients. Nephrol Dial Transplant 2000; 15 Supp l5: 92-6.
- Expert Panel on Detection, Evaluation, and Treatment of High
Blood Cholesterol in Adults. Executive Summary of the Third
Report of the National Cholesterol Education Program (NCEP)
Expert Panel on Detection, Evaluation, and Treatment of High
Blood Cholesterol in Adults. JAMA 2001; 285 (19): 2486-97.
- Gaziano JM, Marison JE, Ridker PM. Primary and Secondary
Prevention of Coronary Heart Disease. In: Libby P, Bonow RO,
Mann Douglas L, Zipes DP, Braunwald E.(eds). Braunwald,s Heart
Disease. Philadelphia: Saunders Elsevier; 2008. p. 1093-155.
- Petrović D, Nikolić A, Stojimirović B. Poremećaj metabolizma
lipida u hroničnoj slabosti bubrega:klinički značaj i lečenje.
Medicinski časopis 2009;43 (1): 21-7.
- Kasiske BL, Lakatua JD, Ma JZ, Louis TA. A meta-analysis of
the effects of dietary protein restriction on the rate of
decline in renal function. Am J Kidney Dis 1998; 31: 954–61.
- Pedrini MT, Levey AS, Lau J, Chalmers TC,Wang PH.The effect
of dietary protein restriction on the progression of diabetic
and nondiabetic renal diseases: a meta-analysis. Ann Intern Med
1996; 124: 627–32.
- Fouque D, Laville M, Boissel JP, Chifflet R, Labeeuw M, Zech
PY. Controlled low protein diets in chronic renal insufficiency:
meta-analysis. BMJ 1992; 304: 216–20.
- Ihle BU, Becker GJ, Whitworth JA, Charlwood RA, Kincaid
Smith PS. The effect of protein restriction on the progression
of renal insufficiency. N Engl J Med 1989; 321: 1773–7.
- NKF-DOQI Clinical Practice Guidelines for anemia of chronic
renal failure. IV administration of epoetin. Am J Kidney Dis
1997; 30 Suppl 3: S213.
- Fink JC, Blahut SA, Reddy M, Light P. Use of erytropoietin
before the initiation of dialysis and its impact on morbidity
and mortality. Am J Kidney Dis 2001; 2: 348-55.
- Bleyer AJ, Shemanski LR, Burke GL, Hansen KJ, Appel RG.
Tobacco, hypertension, and vascular disease: risk factors for
renal functional decline in an older population. Kidney Int
2000; 57: 2072–9.
- Chase HP, Garg SK, Marshall G, Berg CL, Harris S, Jackson
WE, et al. Cigarette smoking increases the risk of albuminuria
among subjects with type I diabetes. JAMA 1991; 265: 614–17.
- Stegmayr B, Lithner F.Tobacco and end stage diabetic
nephropathy. Br Med J Clin Res Ed 1987; 295: 581–2.
|
|
|
|

