| |
|
|
UVOD
Plazmafereza je terapijski postupak izdvajanja plazme pomoću
selektivno propustljive membrane ili procesom centrifugiranja, pri
čemu se izdvojena plazma nadoknađuje rastvorima za supstituciju (5%
rastvora albumina, sveža smrznuta plazma) [1–5]. Ovim postupkom se
iz krvi bolesnika odstranjuju autoantitela, imunski kompleksi,
krioglobulini, monoklonski laki lanci imunoglobulina i
prozapaljenski medijatori, u cilju smanjenja oštećenja organa
(prekidanja lanca patogeneze) i sprečavanja napredovanja patoloških
procesa [1–5].
Osnovne preporuke za propisivanje plazmafereze
Tretman plazmafereze zahteva stabilan i funkcionalan vaskularni
pristup, koji treba da obezbedi konstantan protok krvi 50–100ml/min
[6]. Izbor vaskularnog pristupa zavisi od trajanja procedure
plazmafereze: periferna vena, centralni venski kateter, tunelizacija
centralnog venskog katetera, arterio-venska fistula [6]. Za
plazmaferezu u bolestima bubrega uglavnom se koristi centralni
venski kateter, koji se plasira u unutrašnju jugularnu venu, venu
subklaviju ili femoralnu venu. Centralni venski kateter obezbeđuje
protok krvi od 100 do 150ml/min, a transmembranski pritisak (TMP) je
manji od 50mmHg (radi izbegavanja hemolize). Stepen odstranjivanja
plazme iznosi 30 do 50ml/min, tako da je prosečno vreme potrebno da
se obavi jedna seansa plazmafereze manje od 2h [3, 4]. Za
antikoagulaciju se koristi citrat ili nefrakcionisani heparin
(standardna heparinizacija) [7]. Za većinu bolesnika, inicijalna
udarna doza iznosi 50U/kg, a nastavlja se sa 1000U/h. Za procenu
statusa koagulacije koristi se ACT – activated clotting time
(normalna vrednost iznosi 145 sekundi), čija ciljna vrednost treba
da iznosi 180–220 sekundi (1,5–2,0 puta iznad normalne vrednosti).
Ukoliko je ACT<180 sekundi, dozu heparina povećati za 500U/h, a ako
je ACT>240 sekundi, prekinuti sa primenom heparina [3, 4, 7].
Efikasnost plazmafereze
Efikasnost plazmafereze zavisi od zapremine plazme koja se
zamenjuje, volumena distribucije pojedinih supstancija, kao i od
stepena njihovog vezivanja za proteine plazme. Zapremina plazme može
da se izračuna uz pomoć odgovarajućih formula: volumen plazme =
0,065 x telesna masa (kg) x 1 – hematokrit, ili volumen plazme =
(1-Hct) x (b x cW), gde su b i c faktori korekcije (b=1530 i c=41 za
muškarce; b=864, c=47,2 za žene), a W je suva telesna masa (kg)
[1–5]. Volumen plazme za zamenu obično iznosi 35–40ml/kg telesne
mase, a u pojedinim bolestima i do 60ml/kg telesne mase [1–5].
Zapremina plazme koja se menja zavisi od kliničkog stanja bolesnika,
a ukupan broj i učestalost plazmafereza zavisi od težine bolesti.
Uglavnom se u toku jedne pojedinačne plazmafereze menja 1,0–1,5
volumen plazme (2800–4200ml) [1–5]. Plazmaferezom se najbolje
odstranjuju supstancije koje se u visokom procentu nalaze u
intravaskularnom odeljku, a to su supstancije koje imaju mali
volumen distribucije (Vd<0,2 l/kg) i visok stepen vezivanja za
proteine plazme (>80%) [1–5]. Najveće smanjenje koncentracije
supstancija u plazmi se postiže u toku prve seanse plazmafereze
(63%). Svaka naredna plazmafereza je manje efikasna u odstranjivanju
supstancija iz krvi (druga PE 25%, treća PE 9%) [1–5]. Plazmafereza
se preporučuje svaki drugi dan radi prelaska supstancija iz
ekstravaskularnog u intravaskularni odeljak (u toku 24h do 36h
koncentracija makromolekula u intravaskularnom prostoru se poveća za
35%) [1–5].
Supstitucija plazme
Supstitucija plazme se vrši sa 5% rastvora albumina ili svežom
smrznutom plazmom, a moguća je i njihova kombinacija (5% rastvora
albumina + sveža smrznuta plazma – SSP). U bolestima bubrega
(Goodpastureov sindrom, renalni ANCA pozitivni vaskulitisi,
membrano-proliferativni glomerulonefritis tip 1), uglavnom se za
supstituciju plazme koristi 5% rastvora albumina, a svežu smrznutu
plazmu zahtevaju trombotična trombocitopenijska purpura (TTP),
atipični hemolitičko-uremijski sindrom (aHUS), katastrofični
antifosfolipidni sindrom (CAPS), brzoprogresivni glomerulonefritis
sa difuznom alveolarnom hemoragijom (Diffuse Alveolar Hemorrhage –
DAH) i membranoproliferativni glomerulonefritis tip 2 (MPGN tip 2)
[4, 5].
Prednosti supstitucije sa 5% rastvora albumina su: retka alergijska
reakcija, nemogućnost širenja transmisivnih bolesti, a glavni
nedostatak je smanjenje koncentracije faktora koagulacije,
„depleciona koagulopatija” i povećan rizik od krvarenja [1–5]. Posle
pojedinačne plazmafereze protrombinsko vreme (PT) se produži za 30%,
a aktivisano parcijalno tromboplastinsko vreme (aPTT) dvostruko.
Višestruki uzastopni/svakodnevni tretmani produžavaju PT/aPTT i
povećavaju rizik od krvarenja. U cilju smanjenja rizika od
krvarenja, potrebno je kod bolesnika posle plazmafereze primeniti
svežu smrznutu plazmu. Pored smanjenja faktora koagulacije, kod
bolesnika kod kojih se u toku plazmafereze supstitucija vrši sa 5%
rastvora albumina, smanjuje se i koncentracija normalnih
imunoglobulina i povećava sklonost ka infekciji. Izmenom jednog
volumena plazme (2800ml plazme) koncentracija imunoglobulina u
serumu se smanji za 60%, a višestruki svakodnevni tretmani zahtevaju
primenu i. v. infuzije imunoglobulina – IVIG (100–400mg/kg) [1–5].
Glavni nedostaci supstitucije plazme svežom smrznutom plazmom su:
alergijske i anafilaktoidne reakcije (blokatore konvertaze
angiotenzina 1 ne treba primenjivati zbog blokiranja metabolizma
kinina), toksičnost citrata (SSP sadrži 14% citrata, koji dovodi do
hipokalcemije i metaboličke alkaloze) i rizik od prenošenja virusa
[1–5]. Glavna prednost sveže smrznute plazme je ta što sadrži
faktore koagulacije, metaloproteazu ADAMTS13, faktor H,
imunoglobuline i što smanjuje rizik od krvarenja kod rizičnih
bolesnika [1–5]. U specifične indikacije za primenu sveže smrznute
plazme za supstituciju odstranjene plazme spadaju: TTP/aHUS, rizik
od „deplecione koagulopatije” i koncentracija fibrinogena u serumu
<1,25g/l [4, 5].
INDIKACIJE ZA PLAZMAFEREZU U TRUDNOĆI: KLINIČKI ZNAČAJ
Glavne indikacije za plazmaferezu u trudnoći su katastrofični
antifosfolipidni sindrom, trombotična trombocitopenijska purpura,
atipični hemolitičko-uremijski sindrom, HELLP sindrom i de novo
brzoprogresivni glomerulonefritis [8–14].
Antifosfolipidni sindrom
Antifosfolipidni sindrom (Antiphospholipid Syndrome – APS) je
klinički sindrom koji se odlikuje arterijskim i/ili venskim
trombozama i/ili spontanim pobačajima koji se ponavljaju. U
laboratorijskim analizama su značajno povišena antifosfolipidna
antitela, dva puta u vremenskom periodu od 12 nedelja [15].
Dijagnoza antifosfolipidnog sindroma se postavlja na osnovu
kliničkih i laboratorijskih parametara. U kliničke parametre
spadaju: vaskularna tromboza koja zahvata 3 ili više arterija, vena
ili malih krvnih sudova, 3 ili više neobjašnjenih, uzastopnih
spontanih pobačaja pre desete nedelje, 1 ili više spontanih pobačaja
u kasnoj trudnoći (posle 10 nedelje gestacije) i 1 ili više
prevremenih porođaja morfološki zdravog neonatusa, pre ili u 34.
nedelji gestacije (zbog preeklampsije, eklampsije ili
insuficijencije placente). Laboratorijski parametrici uključuju:
lupus antikoagulans, pozitivan najmanje dva puta za poslednjih 12
nedelja tokom odvojenih merenja, povećanu koncentraciju
anti-kardiolipinskih antitela klase IgG i/ili IgM (aCL IgG ili
IgM>40GPL/ml) najmanje dva puta za poslednjih 12 nedelja tokom
odvojenih merenja i povećanu koncentraciju anti-β2-glikoprotein-I
antitela klase IgG ili IgM koja je prisutna najmanje dva puta za
poslednjih 12 nedelja tokom odvojenih merenja (anti-β2GPI-antitela
IgG ili IgM>40GPL/ml). Antifosfolipidni sindrom se dijagnostikuje
ukoliko je prisutan najmanje jedan klinički i najmanje jedan
laboratorijski parametar [15].
U zavisnosti od etiologije, antifosfolipidni sindrom može biti
primaran i sekundaran. Sekundarni antifosfolipidni sindrom je
udružen sa autoimunskim bolestima (sistemski eritemski lupus,
sistemska skleroza, dermatomiozitis, primarni Sjögrenov sindrom, M.
Behcet, mešovita bolest vezivnog tkiva i dr), hematološkim bolestima
(limfoproliferativne bolesti, mijeloproliferativne bolesti),
infektivnim bolestima (virusne infekcije, bakterijske infekcije) i
neurološkim bolestima (multiplex sclerosis, myasthenia gravis) [15].
Antifosfolipidni sindrom se može ispoljiti čitavom lepezom
različitih kliničkih manifestacija, u zavisnosti od zahvaćenosti
organa: akutni koronarni sindrom, bolest srčanih zalistaka
(Libman-Sacksov endokarditis), trombocitopenija,
hemolitičko-uremijski sindrom, trombotična trombocitopenijska
purpura, cerebrovaskularni inzult, akutna embolija pluća, akutni
respiratorni distres sindrom, akutno oštećenje bubrega. Trudnoća i
puerperijum kod žena sa antifosfolipidnim sindromom mogu biti
praćeni razvojem komplikacija, kao što su: pobačaj, usporen
intrauterini rast fetusa, arterijska hipertenzija (Pregnancy Induced
Hypertension – PIH) i HELLP sindrom (Hemolysis Elevated Liver
Enzymes Low Platelets – HELLP) [15].
Katastrofični antifosfolipidni sindrom (Asherson’s syndrome) se
odlikuje visokim titrom antifosfolipidnih antitela i razvojem
okluzija malih krvnih sudova, koje u kratkom vremenskom periodu
uzrokuju insuficijenciju više sistema organa, shema 1 [15–22].
Različitost kliničkog ispoljavanja dovela je do razvoja konsenzus
kriterijuma za definiciju i klasifikaciju CAPS-a (Catastriphic
Antyphospholipid Syndrome – CAPS). Dijagnoza CAPS-a se postavlja
ukoliko su prisutna sva četiri kriterijuma: podaci za zahvaćenost
tri ili više sistema organa, razvoj kliničkih manifestacija
istovremeno ili u vremenskom periodu manjem od jedne nedelje,
patohistološki dokaz okluzije malih krvnih sudova u najmanje jednom
organu, pozitivna antifosfolipidna antitela u najmanje dva
pojedinačna slučajna uzorka u toku najmanje 6 nedelja (lupus
antikoagulans, anti-kardiolipinska antitiela, anti-2GPI-antitiela)
[15–22]. U faktore koji podstiču razvoj CAPS-a spadaju: infekcija,
hirurška intervencija, trauma, prekid antikoagulantne terapije i
trudnoća [15–22]. Katastrofični antifosfolipidni sindrom u trudnoći
se može ispoljiti kao HELLP sindrom, tromboza placente, trombotična
mikroangiopatija i tromboza pelvične vene [15–22]. Diferencijalno
dijagnostički treba misliti na mogućnost postojanja i drugih
kliničkih stanja u kojima dolazi do stvaranja ugrušaka krvi u malim
krvnim sudovima, kao što su: trombotična trombocitopenijska purpura
(aktivnost ADAMTS13), atipični hemolitičko-uremijski sindrom
(anti-CFH antitela), HELLP sindrom, sepsa povezana sa diseminovanom
intravaskularnom koagulopatijom (smanjena koncentracija fibrinogena,
produženo protrombinsko (PT) i aktivisano parcijalno
tromboplastinsko vreme [aPTT]) i trombocitopenija izazvana heparinom
(antitela na kompleks heparin-trombocitni faktor 4 [anti-HPF4
antitela]) [15–22].
Lečenje antifosfolipidnog sindroma sastoji se u profilaksi i primeni
aktivnog lečenja. Cilj profilakse je da se spreči novi neželjeni
klinički događaj (novi ugrušak krvi ili spontani pobačaj).
Profilaksa se sastoji u otklanjanju drugih faktora rizika, kao što
su pušenje cigareta, visok krvni pritisak, hiperlipidemija, primena
oralnih kontraceptiva. Primenjuju se male doza aspirina (100mg/dan)
ili klopidogrel, kod bolesnika osetljivih na asprin. Rutinska
primena antikoagulantne terapije se sprovodi u stanjima u kojima
postoji povećan rizik od nastanka krvnog ugruška: dehidratacija,
hirurška intervencija, malignitet, smanjena pokretljivost
(imobilizacija) bolesnika, trudnoća [15–22]. Kod trudnica sa
antifosfolipidnim sindromom za profilasu stvaranja krvnog ugruška,
primenjuju se male doze aspirina (100mg/dan) i heparin male
molekulske mase (enoxaparin) u dozi od 20mg/dan (mala profilaktička
doza), 40mg/dan (srednja profilaktička doza) i 1mg/kg/dan (visoka
profilaktička doza) [17–22]. Primena enoxaparina zahteva monitoring
aktivnosti anti-Xa faktora [17–22].
Profilaksa katastrofičnog antifosfolipidnog sindroma zahteva
energično lečenje svake infekcije odgovarajućim antibioticima.
Bolesnici sa antifosfolipidnim sindromom koji zahtevaju hiruršku
intervenciju, treba da primaju heparin male molekulske mase.
Specifično lečenje se sastoji u primeni heparina male molekulske
mase (enoxaparin 1,0mg/kg/dva puta na dan, uz monitoring aktivnosti
anti-Xa faktora) (lekovi prve linije). Pored antikoagulantne
terapije, primenjuju se pulsne doze kortikosteroida
(metilprednisolon 1000mg/dan, i. v. inf, u toku tri uzastopna dana
(lekovi druge linije). Kod najtežih bolesnika, pored
kortikosteroida, primenjuje se i plazmafereza u toku 4–5 dana.
Plazmaferezom se odstranjuje 2–3 litra plazme, a za supstituciju se
koristi sveže smrznuta plazma [15–22]. Heparin male molekulske mase,
pulsne doze kortikosteroida i plazmafereza se primenjuju i kod
trudnica sa katastrofičnim antifosfolipidnim sindromom [17–22]. Kod
bolesnika kod kojih nema odgovarajućeg odgovora na primenjenu
terapiju (rezistencija na heparin se definiše kao odsustvo odgovora
nakon primene heparina u dozi >25IU/kg/h), u lečenju se koriste
lekovi treće linije (imunosupresivni lekovi: azatioprin [bezbedna
primena u trudnoći], rituksimab, ciklofosfamid) [15–22].
HELLP sindrom
HELLP sindrom (Hemolysis, Elevated Liver enzymes and Low Platelet
count Syndrome – HELLP) je ozbiljna komplikacija trudnoće, težak
oblik preeklampsije koji se odlikuje smanjenim brojem trombocita,
mikroangiopatskom hemoliznom anemijom (razgradnja eritrocita),
povećanom koncentracijom enzima jetre i akutnim oštećenjem bubrega
[23]. Ovaj sindrom se javlja kod 0,5–0,9% svih trudnoća, i kod
10–20% trudnica sa teškom preeklampsijom. Kod 70% trudnica, HELLP
sindrom se razvija pre porođaja, uglavnom između 27. i 37. nedelje
gestacije, a kod preostalog broja trudnica javlja se unutar 48h
nakon porođaja [23].
Za dijagnostikovanje HELLP sindroma od značaja je mikroangiopatska
hemolizna anemija (Microangiopathic Haemolytic Anaemia – MAHA).
Razgradnja eritrocita nastaje zbog njihovog prolaska kroz suženja
nastala oštećenjem endotela i taloženjem fibrina na njegovoj
površini u malim krvnim sudovima različitih organa (glomerulska
endotelioza). Na razgradnju eritrocita ukazuju: nalaz eritrocita
izmenjenog oblika u perifernoj krvi (schizocytes/burr cells),
povećan broj retikulocita, smanjena koncentracija haptoglobina
(<1,0g/l), povećana koncentracija laktat dehidrogenaze u serumu
(LDH600U/l), kao i koncentracija ukupnog bilirubina (≥20,5μmol/l)
[23]. Povećan nivo enzima jetre (asparat aminotransferaza –
AST≥70U/lili alanin aminotransferaza – ALT≥70 U/l) nastaje zbog
oštećenja jetre, a broj trombocita je smanjen, kao posledica
povećanog stvaranja ugrušaka krvi u malim krvnim sudovima organa
[23]. Prema TCS (Tennessee Classification System), klasifikacionom
sistemu, dijagnostički kriterijumi za HELLP sindrom su: hemoliza sa
povećanom koncentracijom laktat dehidrogenaze (LDH>600U/l), povećana
koncentracija AST (≥70U/l) i broj trombocita <100x109/l, tabela 1
[23].
HELLP sindrom je povezan sa komplikacijama trudnice i neonatusa. U
faktore koji predviđaju pogoršanje stanja trudnice spadaju:
koncentracija LDH>1400U/l, AST>150U/l, ALT>100U/l i koncentracija
mokraćne kiseline >460μmol/l [23]. Spontana ruptura subkapsularnog
hematoma jetre (ruptura desnog režnja jetre) u trudnoći je retka,
javlja se kod <2% slučajeva sa HELLP sindromom, a klinički se
ispoljava naglo nastalim bolom u desnom gornjem kvadrantu abdomena,
anemijom i hipotenzijom. Za dijagnostikovanje se koristi
ultrasonografija abdomena, kompjuterizovana tomografija ili
nuklearna magnetna rezonancija [23]. U ozbiljne komplikacije HELLP
sindroma spadaju i abrupcija placente, diseminovana intravaskularna
koagulopatija (DIC) i teško krvarenje posle porođaja. Teška
preeklampsija, HELLP sindrom i abrupcija/odlubljivanje placente su
glavni uzroci DIC-a u trudnoći [23].
Glavni laboratorijski nalazi koji ukazuju na DIC su:
trombocitopenija, povećana koncentracija produkata razgradnje
fibrina, D-dimera, trombocitnog faktora-4, β-tromboglobulina,
trombomodulina, fibrinopeptida A i smanjena koncentracija
antitrombina 3, fibrinogena i proteina C [23]. Neki autori DIC
sindrom definišu kao krvarenje sa brojem trombocita <100 x 109/l,
koncentracijom fibrinogena manjom od 3,0g/l i koncentracijom
produkata razgradnje fibrinogena – FDP (fibrinogen degradation
products) >40mg/l (>40μg/ml) [23]. Poštujući ove kriterijume, DIC
sindrom je dokazan kod 38% trudnica sa HELLP sindromom [23]. Podatak
o DIC sindromu kod trudnica sa teškom preeklmapsijom ili HELLP
sindromom je indikacija za trenutni, brzi i neposredni porođaj.
Odluka o vrsti porođaja, vaginalnim putem ili carskim rezom, donosi
se na osnovu analize sledećih faktora: starost gestacije, cervikalni
Bishop skor, motivacija bolesnice, težina DIC-a. Umerena ili teška
trombocitopenija (posebno kada je broj trombocita manji od 70 x
109/l) je kontraindikacija za regionalnu anesteziju zbog rizika od
spinalnog hematoma [23]. Zbog toga što je DIC progresivno stanje,
rana dijagnoza i brza terapija su krucijalni za smanjenje
morbiditeta i mortaliteta majke i neonatusa. Lečenje uključuje
održavanje i obnavljanje intravaskularnog volumena, primenu
deplazmatisanih eritrocita, u skladu sa nalazom krvne slike (jedna
transfuzija deplazmatisanih eritrocita povećava hemoglobin za 10g/l
i hematokrit za 2–3% kod žena telesne mase 70kg) [23]. Sveža
smrznuta plazma sadrži značajnu količinu drugog (fibrinogen), petog
i osmog faktora koagulacije, a dodatno obezbeđuje i koloidnu potporu
(onkotski pritisak plazme) [23]. Sveža smrznuta plazma se primenjuje
ukoliko je iNR≥1,5 (inicijalna doza iznosi 2 jedinice SSP) [22].
Svaka jedinica je zapremine 200–250ml i povećava koncentraciju
faktora koagulacije za 2–3%. Krioprecipitat je koncentrovani ekstrat
sveže smrznute plazme, bogat je faktorom 2 i faktorom 8, a zapremina
jedne jedinice krioprecipitata iznosi 10–15ml. Transfuziju
krioprecipitata treba razmotriti kod bolesnica sa DIC-om kod kojih
je koncentracija fibrinogena ispod 1,0g/l (100mg/dl) [23]. Većina
autora preporučuje transfuziju trombocita kod bolesnica sa DIC-om
kada je broj trombocita manji od 20 x 109/l ili kada je broj
trombocita manji od 50 x 109/l, ukoliko je planirana hirurška
intervencija ili je prisutno aktivno krvarenje [22]. Jedinica
trombocita je zapremine 4 ml, a jedna jedinica trombocita povećava
broj trombocita za 5–10 x 109/l. Dozira se jedna jedinica na 10kg
telesne mase [23].
Lečenje HELLP sindroma zavisi od težine kliničkog stanja trudnice,
starosti gestacije i stanja fetusa [23]. Standardno lečenje HELLP
sindroma uključuje: primenu magnezijum sulfata (4,0g i. v. bolus, a
zatim nastaviti sa 1,0g/h u toku 24h nakon porođaja),
kortikosteroida i. m. (bethametasone ili dexamethasone – protokol za
sazrevanje pluća fetusa), medikamenata za kontrolu arterijskog
krvnog pritiska i rani porođaj. Pre 24. nedelje gestacije, preporuka
je da se trudnoća prekine (preživljavanje fetusa je nepovoljno, a
visok je rizik od teških komplikacija koje se mogu javiti kod
porodilje). Između 24–34. nedelje gestacije, lečenje ima izgleda i
razuman je postupak. Prema preporukama ACOG (American College of
Obstetricians and Gynecologist), za sazrevanje pluća fetusa koristi
se deksametazon u dozi od 6mg na 12h, u toku 48h. Porođaj je lečenje
izbora za trudnoće starosti ≥34 nedelje. Pogoršanje stanja majke,
eklampsija ili znaci patnje fetusa su indikacija za hitan porođaj u
periodu između 24–34. nedelje gestacije, shema 2 [23–25].
Kada se HELLP sindrom rano dijagnostikuje i pravovremeno i energično
leči, kod najvećeg broja trudnica stanje se popravlja unutar 24–48h
nakon porođaja: dolazi do povećanja broja trombocita i značajnog
smanjenja koncentracije enzima jetre [26–30]. Izuzetno retko, nakon
porođaja stanje trudnice se može pogoršati razvojem insuficijencije
više sistema organa. Kod ovih trudnica kliničko stanje se popravlja
primenom plazmafreze. Plazmaferezu treba primeniti 24–72h nakon
porođaja, u slučajevima kada nije došlo do povećanje broja
trombocita (≥100 x 109/l) i smanjenja koncentracije enzima jetre
(ALT), kada se razvija akutno oštećenje bubrega, respiratorni
distres sindrom ili neurološki poremećaji [26–30]. Plazmafereza se
primenjuje na svakih 24–48h, menja se 3000–4000ml plazme, a za
supstituciju se koristi sveža smrznuta plazma [26–30]. Plazmaferezom
se odstranjuju prokoagulantni faktori koji se oslobađaju iz
trombocita i endotelnih ćelija. Kriterijum za prekidanje
plazmafereze je broj trombocita veći od 100 x 109/l i stabilno
stanje trudnice. Kod 28% trudnica sa HELLP sindromom opisana je
korist od plazmafereze (ne postoji konsenzus oko indikacija i
kriterijuma za plazmaferezu kod trudnica sa HELLP sindromom)
[26–30].
Trombotične mikroangiopatije u trudnoći
Atipični hemolitičko-uremijski sindrom (aHUS)
Atipični hemolitičko-uremijski sindrom je klinički sindrom koji se
odlikuje trombocitopenijom, mikroangiopatskom hemoliznom anemijom
(MAHA), stvaranjem krvnih ugrušaka u malim krvnim sudovima bubrega i
akutnim oštećenjem bubrega [31, 32]. Nastaje zbog poremećaja
funkcije proteina koji regulišu aktivnost alternativnog puta sistema
komplementa, kao što su faktor komplementa H (CFH), faktor
komplementa I (FCI), faktor komplementa B (FCB), membrana kofaktor
protein (CD46) i C3 komponenta komplementa (pojačana aktivnost
alternativnog puta sistema komplementa) [31, 32]. Alternativni put
aktivacije sistema komplementa je stalno aktivan (nizak stepen
aktivnosti) zbog spontane hidrolize C3 komponente komplementa.
Fragment C3b se vezuje za Bb (faktor B se pod dejstvom proteaze
razlaže na fragment Bb). Tako nastali kompleks C3bBb razlaže nove C3
komponente komplementa (C3a, C3b) i označava se kao „C3 konvertaza
alternativnog puta sistema komplementa” [31, 32]. Fragment C3b se
vezuje za C3bBb i tom prilikom nastaje C5 konvertaza alternativnog
puta sistema komplementa (C3bBb3b). Razlaganjem C5 komponente
komplementa nastaje C5b-9 kompleks, koji razgrađuje membrane ćelija
organa (membrane endotelnih ćelija glomerula kod aHUS-a) [31, 32].
Nedostatak ili poremećaj funkcije faktora H (mutacija gena 1q32
[20–30%], anti-CFH-antitela [60%]) za posledicu ima pojačanu
aktivnost fragmenta C3b, pojačanu aktivaciju alternativnog puta
sistema komplementa (C3a, C5a, C5b-9), oštećenje endotelnih ćelija i
stvaranje krvnih ugrušaka u malim krvnim sudovima organa,
uključujući i bubreg [31, 32]. Najčešći uzrok atipičnog HUS-a
povezanog sa trudnoćom je mutacija gena za faktor komplementa H
(domen SCR19-20). Atipični HUS povezan sa trudnoćom (P-aHUS) se
uglavnom javlja u periodu posle porođaja (postpartusni period). Kod
80% trudnica sa aHUS-om potrebna je dijalizna potporna terapija, a
kod 60% trudnica kod kojih se razvije aHUS dolazi do razvoja
završnog stadijuma hronične bolesti bubrega, u vremenskom periodu
manjem od jednog meseca nakon akutne epizode P-aHUS-a [33].
Dijagnostikovanje poremećaja regulacije alternativnog puta sistema
komplementa uključuje: određivanje koncentracije C3 i C4 komponente
komplementa u serumu, test za dokazivanje C3 nefritičkog faktora
(C3nephritic factor – C3NF), određivanje koncentracije CFH, CFI i
CFB. Vrednosti CFH i CFI manje od 60% normalne vrednosti ukazuju na
postojanje deficita [34, 35]. Dijagnostikovanje aHUS-a uključuje i
procenu ispoljavanja membranskog kofaktor proteina (MCP) na membrani
leukocita (polimorfonuklearni ili mononuklearni leukociti) FASC
(fluorescence-activated cell sorter) metodom, analizu mutacije gena
za CFH, CFI, CFB, MCP, C3 i određivanje titra anti-CFH-antitela [34,
35]. Za diferencijalnu dijagnozu aHUS-a treba uraditi koncentraciju
enzima jetre (HELLP sindrom), aktivnost ADAMTS13 (trombotična
trombocitopenijska purpura – TTP), test za trudnoću (okidač razvoja
aHUS-a) i testove za dijagnostikovanje autoimunskih bolesti (okidač
za razvoj aHUS-a): antinuklearna antitela – ANA (sistemski eritemski
lupus), anti-dsDNA antitela (sistemski eritemski lupus), antitela na
antigene citoplazme neutrofila – ANCA (vaskulitis), antifosoflipidna
antitela: lupus antikoagulans (LA), kardiolipinska antitela (aCL),
anti-β2-GPI antitela (antifosfolipidni sindrom – APS/CAPS),
anti-Scl-70 antitela (sistemska skleroza) [34, 35].
Kod bolesnika sa aHUS-om prva linija lečenja je plazmafereza
[35–37]. Plazmaferezom se odstranjuju nefunkcionalni proteini koji
regulišu aktivnost alternativnog puta sistema komplementa (CFH, CFI,
CFB, C3), kao i autoantitela na CFH (anti-CFH antitela) [35–37].
Plazmaferezu treba primeniti unutar 24h od kliničkog ispoljavanja
aHUS-a, svakodnevno u toku 3–5 dana, menja se 1,0-1,5 volumen plazme
(60–65ml/kg), a za supstituciju se koristi sveža smrznuta plazma
[35–37]. U toku lečenja plazmaferezom, svakodnevno se određuje broj
trombocita, koncentracija kreatinina i koncentracija laktat
dehidrogenaze u serumu [35–37]. Nemogućnost povećanja broja
trombocita (>150 x 109/l), smanjenja koncentracije LDH u serumu na
normalan nivo, smanjenja koncentracije kreatinina u serumu za ≥25% u
odnosu na početnu vrednost posle pet uzastopnih svakodnevnih
plazmafereza se definiše kao aHUS-a rzistentan na plazmaferezu
[35–39]. Kod bolesnika sa aHUS-om kod kojih postoji rezistencija ili
nekompletan odgovor na plazmaferezu (održiva hemoliza i/ili
trombocitopenija i/ili odsustvo popravljanja funkcije bubrega posle
pet uzastopnih svakodnevnih plazmafereza), zavisnost od plazmafereze
(relaps bolesti posle prekidanja plazmafereze: pad broja trombocita,
porast koncentracije LDH u serumu), nepodnošljivost sveže smrznute
plazme, nemogućnost plasiranja centralnog venskog katetera za
plazmaferezu, u lečenju se primenjuje blokator C5 komponente
komplementa (monoklonsko antitelo eculizumab) [35–39]. Lečenje se
sastoji iz dve faze: inicijalna i faza održavanja. Zbog povećanog
rizika od meningokokne infekcije, dve nedelje pre primene
eculizumaba potrebno je primeniti meningokoknu vakcinu (US Advisory
Committee in Immunization Practices – USACIP) [35–41]. U inicijalnoj
fazi, eculizumab se primenjuje u dozi od 900mg, u obliku i. v.
infuzije u toku 25–45 minuta, jednom nedeljno, u toku četiri
nedelje. U fazi održavanja, eculizumab se primenjuje u dozi od
1200mg, u obliku i. v. infuzije u toku 25–45 minuta, pete nedelje, a
zatim svake druge nedelje [35–41]. Procena odgovora na primenjenu
terapiju uključuje praćenje broja trombocita, određivanje
koncentracije kreatinina i laktat dehidrogenaze u serumu na svake
dve nedelje. Remisija aHUS-a (normalizacija hematoloških parametara)
se definiše kao normalan broj trombocita (broj trombocita >150 x
109/l) i normalna koncentracija LDH u serumu u najmanje dva
uzastopna merenja, sa razmakom od najmanje četiri nedelje (≥4
nedelje) [35–41]. Posle primene eculizumaba i postizanja kompletne
remisije, potreban je monitoring za otkrivanje simptoma i znakova
aHUS-a u vremenskom periodu od najmanje 12 nedelja (tri meseca) [40,
41]. Kod trudnica sa aHUS-om koji je rezistentan na plazmaferezu,
eculizumab se može primeniti nakon porođaja (postpartusni period)
[39-41].
Trombotična trombocitopenijska purpura u trudnoći (TTP)
Trombotična trombocitopenijska purpura (TTP) je klinički sindrom
koji se odlikuje trombocitopenijom, mikroangiopatskom hemoliznom
anemijom, visokom telesnom temperaturom, poremećajima centralnog
nervnog sistema i bubrežnom insuficijencijom [42–44]. Nastaje zbog
smanjene aktivnosti metaloproteinaze ADAMTS13, enzima koji cepa
makromolekule von Wilrbrandovog faktora (vWF), koga luče endotelne
ćelije malih krvnih sudova. U zavisnosti od uzroka koji dovodi do
smanjene aktivnosti ADAMTS13, razlikujemo kongenitalni (mutacija
gena za sintezu ADAMTS13) i stečeni (anti-ADAMTS13 IgG antitela)
oblik TTP [42–44]. Kod kongenitalne TTP (cTTP), aktivnost ADAMTS13
je ≤5%, a kod stečne TTP (sTTP) je ≤10% [42–44]. Kao posledica
smanjene aktivnosti ADAMTS13, dolazi do stvaranja krvnih ugrušaka
(vWF + trombociti) u malim krvnim sudovima mozga i bubrega [42–44].
Akutna trombotična trombocitopenijska purpura se klinički ispoljava
trombocitopenijom (epistaksa, petehije, krvni podlivi, krvarenje iz
gingiva, hematurija, gastrointestinalno krvarenje, mikrohematurija),
poremećajima centralnog nervnog sistema (konfuzija, glavobolja,
poremećaji vida), visokom telesnom temperaturom (T>37,50C) i
poremećajima funkcije bubrega (mikrohematurija, proteinurija)
[42–44]. Plazmafereza je prva linija terapije. Cilj plazmafereze je
da se postigne remisija bolesti (broj trombocita >150 x 109/l u toku
dva uzastopna dana, normalna ili gotovo normalna koncentracija
laktat dehidrogenaze u serumu, stabilizovanje ili popravljanje
neurološkog poremećaja) [44]. Primenjuje se svakodnevno u toku pet
dana, menja se najmanje jedan volumen plazme (2800ml), a za
supstituciju izdvojene plazme koristi se sveža smrznuta plazma. Kod
bolesnika kod kojih se dijagnostikuje stečeni oblik TTP
(anti-ADAMTS13 antitela), pored plazmafereze, primenjuju se
kortikosteroidi per os, u dozi od 1,0mg/kg/dan [44].
Refraktarni oblik TTP (rezistencija na plazmaferezu) se definiše kao
odsustvo odgovora nakon pet svakodnevnih seansi plazmafereze
(odsustvo povećanja broja trombocita i stabilizacije kliničkog
stanja bolesnika). Kod bolesnika sa refraktarnim oblikom TTP, koji
su klinički nestabilni i imaju neurološke simptome, primenjuju se
pulsne doze metilprednizolona (metilprednisolone: 1,0g i. v.
inf/dan, u toku tri uzastopna dana), plazmaferezom se menja 1,5
volumen plazme i rituksimab (i. v. inf: 375mg/m2/nedeljno, u toku 4
nedelje), shema 1 [44].
Kod trudnica, trombotična trombocitopenijska purpura se klinički
ispoljava glavoboljom, proteinurijom, preeklampsijom, poremećajem
vida, migrenom, oštećenjem bubrega, bolom u abdomenu, embolizacijom
pluća, akutnim respiratornim distres sindromom [42–44].
Kongentitalni oblik TTP povezan sa trudnoćom se najčešće javlja u
postpartusnom periodu (monitoring za cTTP u postpartusnom periodu).
Lečenje započinje plazmaferezom. Ukoliko se dijagnostikuje akutna
epizoda stečene TTP-a, primenjuje se plazmafereza, kortikosteroidi i
azatioprin [42–44]. Kod trudnica kod kojih je ranije
dijagnostikovana TTP, lečenje infuzijama plazme treba primeniti
između 8–10. nedelje gestacije, u početku svake druge nedelje, a
učestalost infuzija sveže smrznute plazme se povećava svake nedelje
u toku drugog i ranog početka trećeg trimestra trudnoće ili ako broj
trombocita padne ispod 150 x 109/l, ili se koncentracija laktat
dehidrogenaze povećava u serumu (elektivna primena sveže smrznute
plazme), u kombinaciji sa malim dozama aspirina (75–100mg/dan) i
heparinom male molekulske mase [42–44]. Infuzija sveže smrznute
plazme se primenjuje svake nedelje u periodu od šest nedelja nakon
porođaja (postpartusni period – prevencija razvoja akutne epizode
cTTP) [42–44]. Kod stečenog oblika TTP povezane sa trudnoćom
(pozitivna anti-ADAMTS13 IgG antitela), pre začeća treba primeniti
rituksimab u dozi od 375mg/m2/nedeljno, 6 doza (nivo anti-ADAMTS13
IgG se smanjuje ispod normalne vrednosti, normalna koncentracija
anti-ADAMTS13 iznosi manje od 12U/ml, a povećava se aktivnost
ADAMTS13) [43–46]. Dvanaest meseci nakon primene rituksimaba
savetuje se začeće (planirana trudnoća) [43–46]. Za prevenciju
akutne epizode sTTP u trudnoći primenjuje se infuzija sveže smrznute
plazme (10ml/kg) svake druge nedelje, 8–10. nedelje gestacije, pa
sve do porođaja (kada aktivnost ADAMTS13 padne ispod 10%, normalna
aktivnost ADAMTS13 iznosi 50–100%), u kombinaciji sa malim dozama
aspirina i heparinom male molekulske mase (plazmafereza se koristi u
akutnoj fazi bolesti [akutne epizoda TTP], a za profilaksu se
koristi infuzija sveže smrznute plazme) [43–46].
De novo brzoprogresivni glomerulonefritis u trudnoći
Brzoprogresivni glomerulonefritis (Rapidly Progressive
Glomerulonephritis – RPGN) je glomerulska bolest bubrega, koja se
odlikuje izraženom proliferacijom epitelnih ćelija Bowmanove kapsule
i stvaranjem polumesečastih formacija u više od 50% glomerula
[47–50]. U zavisnosti od etiopatogeneze, razlikujemo tri tipa
brzoprogresivnog glomerulonefritisa: RPGN posredovan anti-GBM
antitelima (tip 1), RPGN posredovan imunskim kompleksima (tip 2),
RPGN posredovan antitelima na antigene citoplazme neutrofila (ANCA –
tip 3) [47–50]. Bolest počinje naglo, neočekivano, sa simptomima i
znacima koji ukazuju na glomerulonefritis, kao što su oligurija,
prisustvo krvi u mokraći (hematurija), otoci i hipertenzija. Glavne
kliničke karakteristike brzoprogresivnog glomerulonefritisa su brzo
i progresivno opadanje funkcije bubrega (progresivni porast azotnih
materija, muka, gađenje, povraćanje), mikrohematurija
(akantociturija >5%, eritrocitni cilindri), proteinurija
nenefrotskog ranga (<3,5g/24h/1,73m2), hipertenzija i oligurija.
Zbog oligurije dolazi do zadržavanja tečnosti u organizmu, a to za
posledicu ima razvoj hipertenzije, hemoptizija i edema pluća
[47–50]. Goodpastureov sindrom je brzoprogresivni glomerulonefritis
tip 1 udružen sa difuznom alveolarnom hemoragijom (otežano disanje,
bol u grudima, hemoptizija) [47–50]. Dijagnoza brzoprogresivnog
glomerulonefritisa se postavlja na osnovu anamneze, fizikalnog
pregleda, laboratorijskog ispitivanja (procena funkcije bubrega,
pregled urina), ispitivanja imunskog sistema (anti-GBM antitela,
ANCA, ANA, anti-dsDNA antitela, C3, C4 komponenta komplementa) i
biopsije bubrega (svetlosna/elektronska mikroskopija:
ćelijski/ožiljni polumeseci u >50% glomerula, imunofluorescentna
mikroskopija: linearni depoziti (anti-GBM antitela), granulirani
depoziti (imunski kompleksi), nalaz negativan ili slabo pozitivan
(ANCA) [47–50]. Zlatni standard za dijagnostikovanje difuzne
alveolarne hemoragije je bronhoalveolarna lavaža (nalaz makrofaga
bogatih hemosiderinom) [47–50].
Lečenje brzoprogresivnog glomerulonefritisa tipa 1 se sastoji u
primeni plazmafereze (odstranjivanje anri-GBM antitela),
kortikosteroida i imunosupresiva (blokiranje stvaranja novih
anti-GBM antitela) [47–52]. Lečenje započinje pulsnim dozama
metilprednizolona (metilprednozolo 1000mg i. v. inf./dan, u toku tri
dana, a zatim pronizon tablete, per os u dozi od 1,0mg/kg/dan), uz
primenu ciklofosfamida (2,0 mg/kg/dan, per os, u toku tri meseca) i
plazmafereze [47–52]. U toku seanse plazmafereze menja se 4000ml
plazme, svakodnevno u toku 14 dana (prvih sedam dana svakodnevno, a
zatim na svaki drugi dan preostalih sedam seansi) ili dok titar
anti-GBM antitela ne bude nemerljiv. Za supstituciju se koristi 5%
rastvora albumina, a kod bolesnika sa difuznom alveolarnom
hemoragijom 5% rastvora albumina u kombinaciji sa svežom smrznutom
plazmom [47–52].
Kod trudnica sa de novo brzoprogresivnim glomerulonefritisom
(Goodpasture’s syndrome) nepovoljan je ishod majke (gestacijski
dijabetes melitus, preeklampsija, infekcije) i fetusa (usporen rast
fetusa, prevremeni porođaj, kongenitalni poremećaji) [53]. Optimalno
lečenje de novo brzoprogresivnog glomerulonefritisa u trudnoći
zahteva biopsiju bubrega majke (visok rizik od krvarenja), bezbedan
režim imunosupresivne terapije i hemodijalizu [53]. Terapija za
indukciju remisije de novo Goodpastureovog sindroma u trudnoći
uključuje primenu kortikosteroida, azatioprina i plazmafereze [53].
Kortikosteroidi imaju mali teratogeni potencijal, ali povećavaju
rizik od gestacijskog dijabetes melitusa. Azatioprin (1–3mg/kg/dan,
per os, u toku 12 meseci) u kombinaciji sa plazmaferezom može se
koristiti za indukciju remisije i kod najtežih de novo oblika
Goodpastureovog sindroma [53]. Primena plazmafereze u trudnoći je
generalno bezbedna. Primenjuje se svaki ili svaki drugi dan, u toku
2–3 nedelje (sve dok koncentracija anti-GBM antitela ne bude
nemerljiva u serumu majke). Za supstituciju se koristi 5% rastvora
albumina (sveža smrznuta plazma se koristi samo ako postoji rizik od
krvarenja: plućna hemoragija) [53].
De novo anti-GBM bolest bubrega u trudnoći je povezana sa lošim
ishodom majke i fetusa. Biopsija bubrega, imunosupresivna terapija,
plazmafereza, hemodijaliza i multidisciplinarni pristup (ginekolog,
nefrolog, klinički farmakolog, anesteziolog, pedijatar) su neophodni
za optimizaciju lečenja i popravljanja ishoda majke i fetusa [53].
Lečenje akutne bubrežne insuficijencije u trudnoći
Najčešći uzroci akutne bubrežne insuficijencije u trudnoći su
trombotične mikroangiopatije (aHUS, TTP) i HELLP sindrom [24, 25,
54–56]. Akutno oštećenje bubrega u trudnoći, koje zahteva lečenje
dijalizom, javlja se kod 1,0 na 10.000–15.000 trudnoća. Indikacije
za akutnu dijalizu u trudnoći uključuju: prisustvo simptoma i
znakova uremije (encefalopatija, perikarditis ili neuropatija),
opterećenje volumenom (višak tečnosti u organizmu), hiperkaliemiju i
metaboličku acidozu koje ne reaguju na početnu/inicijalnu terapiju
[25]. Primenjuje se svakodnevna intermitentna hemodijaliza
(>20h/nedeljno), sa blagom ultrafiltracijom (500ml/dijalizna seansa)
u cilju sprečavanja razvoja hipotenzije i hipoperfuzije placente
(neto ultrafiltracija za svaku pojedinačnu seansu hemodijalize treba
da bude ≤500ml) [25]. Svakodnevna hemodijaliza (>20h/nedeljno)
popravlja odstranjivanje uremijskih toksina, obezbeđuje hemodinamsku
stabilnost trudnice i optimalnu perfuziju placente (posteljice).
Koristi se bikarbonatni rastvor za hemodijalizu (koncentracija
bikarbonata 25mmol/l), sa koncentracijom natrijuma od 135mmol/l. Za
antikoagulaciju vantelesne cirkulacije koristi se nefrakcionisani
heparin (ne prolazi kroz placentu) [25]. Kod hemodinamski
nestabilnih trudnica u kritičnom stanju, sa akutnim oštećenjem
bubrega i insuficijencijom više sistema organa, kao dijalizna
potporna terapija koriste se kontinuirani modaliteti dijalize [25].
KOMPLIKACIJE PLAZMAFEREZE
Plazmafereza je bezbedna i pouzdana terapijska procedura.
Komplikacije se javljaju retko i povezane su sa vaskularnim
pristupom (centralni venski kateter), alergijskim reakcijama na
svežu smrznutu plazmu, rizikom od krvarenja i hipokalciemijom [57,
58]. Hipokalciemija nastaje kao posledica citrata koji se nalazi u
svežoj smrznutoj plazmi ili kao posledica primene citratne
antikoagulacije. Simptomi hipokalciemije mogu biti blagi
(glavobolja, napadi crvenila, perioralne i akralne parastezije,
podrhtavanje, razdražljivost, vrtoglavica), umereni (gubitak dubokih
refleksa, grčevi mišića, karpopedalni spazam) i teški (tetanija,
epilepitički napad, spazam larinksa, komorski poremećaji srčanog
ritma [produžen QT interval]) [7, 58]. Za prevenciju i otklanjanje
blagih simptoma hipokalciemije (kod bolesnika sa anamnestičkim
podatkom za parastezije), kalcijum se primenjuje per os (CaCO3 tabl.
1,0g, 2,0g 30 minuta pre plazmafereze). Kod bolesnika sa simptomima
umerene ili teške hipokalciemije, kalcijum se primenjuje
parenteralno (calcium gluconate, 10% rastvora [1,0g/10ml sadrži 90mg
elementarnog kalcijuma na gram]). Kalcijum glukonat se primenjuje se
u obliku i. v. inf: 10ml 10%Ca gluconate + 100ml 0,9%NaCl sol. u
toku 15 minuta, 15 minuta posle započinjanja seanse plazmafereze, a
može se ponavljati na svakih 4–6h, u zavisnosti od koncentracije
jonizovanog kalcijuma u serumu [7, 58]. Pored kalcijum glukonata,
primenjuje se i kalcijum hlorid (calcium chloride, 10% rastvora
[1,0g/10ml sadrži 270mg elementarnog kalcijuma na gram]). Primenjuje
se u obliku i. v. inf: 3,3ml 10%CaCl2 + 100ml 0,9%NaCl sol. u toku
15 minuta, a može se ponavljati na svakih 4–6h, u zavisnosti od
koncentracije jonizovanog kalcijuma u serumu [7, 58]. Ukoliko dođe
do razvoja torzade (hipokalciemija, hipomagneziemija), primenjuje se
magnezijum sulfat (i. v: 1–2g MgSO4, na svakih 5–20 minuta) [7, 58].
U ostale metaboličke komplikacije citratne nefropatije spadaju:
hipomagneziemija, metabolička alkaloza i hipokaliemija [7, 56]. Dve
najznačajnije komplikacije primene heparina u toku seanse
plazmafereze su: povećan rizik od krvarenja i trombocitopenija
izazvana heparinom (Heparin-Induced Thrombocytopenia – HIT) [58–60].
Koagulopatija izazvana tretmanom plazmafereze („depleciona
koagulopatija”) javlja se kod bolesnika kod kojih se za supstituciju
izdvojene plazme koristi 5% rastvora albumina [60, 61]. Posle prve
seanse plazmafereze koncentracija većine faktora koagulacije,
uključujući i fibrinogen i antitrombin 3, se smanjuje za približno
60%. Vraćanje koncentracije ovih faktora na normalan nivo je
bifazično: faza brzog i faza postepenog povećanja koncentracije
faktora u serumu. U prva 4h posle seanse dolazi do brzog povećanja
koncentracije ovih faktora u serumu, kao posledica njihovog prelaska
iz ekstra u intravaskularni odeljak. Postepeno povećanje je
posledica novog stvaranja. Normalna koncentracija faktora
koagulacije u serumu postiže se za 48h do 72h [61, 62]. Neposredno
posle tretmana protrombinsko vreme se povećava za 30%, a aktivisano
parcijalno tromboplastinsko vreme se dvostruko povećava. Rizik od
krvarenja postoji ako se tretmani plazmafereze koriste svakodnevno
ili ≥3 puta nedeljno, a može se umanjiti dodavanjem sveže smrznute
plazme (500–1000ml/2–4 jedinice) za supstituciju izmenjene plazme
[61, 62]. Hipotenzija u toku seanse plazmafereze može da nastane
zbog: tečnosti za supstituciju smanjene onkotske aktivnosti (3,5%
rastvora albumina), poremećaja srčanog ritma (hipokalciemija),
reakcije povezane sa bradikininom (primena blokatora konvertaze
angiotenzina 1, krvarenja („depleciona koagulopatija”),
anafilaktička reakcija (sveža smrznuta plazma, bioinkompatibilnost
membrane) i embolije pluća [61, 62].
ZAKLJUČAK
Plazmafereza je pouzdana i bezbedna terapijska procedura u
trudnoći. Ovim postupkom se iz krvi trudnica odstranjuju
autoantitela (anti-CFH-antitela, anti-ADAMTS13-antitela), a svežom
smrznutom plazmom, koja se koristi za supstituciju, obnavlja se
aktivnost faktora koji regulišu aktivnost alternativnog puta sistema
komplementa i metaloproteinaze koja cepa vonWilebrandov faktor.
Plazmafereza u trudnoći popravlja ishod trudnice i trudnoće.
LITERATURA
- Kaplan AA. Therapeutic Plasma Exchange: Core Curriculum
2008. Am J Kidney Dis 2008; 52 (6): 1180–96.
- Pusey CD, Levy JB. Plasmapheresis in Immunologic Renal
Disease. Blood Purif 2012; 33 (1–3): 190–8.
- Ismail N, Neyra R, Hakim R. Plasmapheresis.In: Clinical
Nephrology, Dialysis and Transplantation. Malluche HH, Sawaya
BP, Hakim RM, Sayegh MH, eds. Dustri-Verlag 2009.
- Sanchez AP, Ward DM. Therapeutic Apheresis for Renal
Disorders. Semin Dial 2012; 25 (2): 119–31.
- Williams ME, Balogun RA. Principles of Separation:
Indications and Therapeutic Targets for Plasma Exchange. Clin J
Am Soc Nephrol 2014; 9: 181–90.
- Okafor C, Kalantarinia K. Vascular Access Considerations for
Therapeutic Apheresis Procedures. Semin Dial 2012; 25 (2):
140–4.
- Lee G, Arepally GM. Anticoagulation Techniques in Apheresis:
From Heparin to Citrate and Beyond. J Clin Apher 2012; 27 (3):
117–25.
- Cervera R, Espinoza G. Update on the Catastrophic
Antiphospholipid Syndrome and the “CAPS Registry”. Semin Thromb
Hemost 2012; 38 (4): 333–8.
- Lahmer T, Heemann U. Anti-glomerular basement membrane
antibody disease: A rare autoimmune disorder affecting the
kidney and the lung. Autoimmun Rev 2012; 12 (2): 169–73.
- Scully M, Hunt BJ, Benjamin S, Liesner R, Rose P, Peyvandi
F, et al on behalf of British Committee for Standards in
Hematology. Guidelines on the diagnosis and management of
thrombotic thrombocytopenic purpura and other thrombotic
microangiopathies. Br J Hematol 2012; 158 (3): 323–35.
- Kavanagh D, Goodship TH, Richards A. Atypical Hemolityc
Uremic Syndrome. Semin Nephrol 2013; 33 (6): 508–30.
- Vafaeimanesh J, Nazeri A, Hosseinzadeh F. Plasmapheresis: a
lifesaving treatment in severe cases of HELLP syndrome. Caspian
J Intern Med 2014; 5 (4): 243–7.
- Thomson B, Clark WF, Hladunevich M, Patel A, Blake P,
Eastabrook G, Matsui D, Sharma A, House A. Maternal, pregnancy
and fetal outcomes in de novo anti-glomerular basement membrane
antibody disease in pregnancy: a systematic review. Clin Kidney
J 2014; 7 (5): 450–6.
- Marson P, Gervasi MT, Tison T, Colpo A, De Silvestro G.
Therapeutic apheresis in pregnancy: General considerations and
current practice. Transfus Apher Sci 2015; 53 (3): 256–61.
- Erkan D, Espinosa G, Cervera R. Catastrophic
antiphospholipid syndrome: Updated diagnostic algoritms.
Autoimmun Rev 2010; 10 (1): 74–9.
- Ortel TL, Erkan D, Kitchens CS. How I treat catastrophic
thrombotic syndromes. Blood 2015; 126 (11): 1285–93.
- Cervera R. Catastrophic antiphospholipid syndrome (CAPS):
update from the CAPS Registry. Lupus 2010; 19 (4): 412–8.
- Espinosa G, Cervera R. Current treatment of antiphospholipid
syndrome: lights and shadows. Nat Rev Rheumatol 2015; 11 (6):
586–96.
- Gomez-Puerta JA, Cervera R, Espinosa G, Bucciarelli S, Font
J. Pregnancy and puerperium are high susceptibility periods for
the development of catastrophic antiphospholipid syndrome.
Autoimmunity Rev 2006; 6 (2): 85–8.
- Makatsariya A, Asherson RA, Bitsadze V, Baimuradova S,
Akinshina S. Catastrophic antiphospholipid (Asherson’s) syndrome
and genetic thrombophilic disorders in obstetrics. Autoimmunity
Rev 2006; 6 (2): 89–93.
- Hanouna G, Morel N, Houng DLT, Josselin L, Vauthier-Brouzes
D, Saadoun D, et al. Catastrophic antiphospholipid syndrome and
pregnancy: an experience of 13 cases. Rheumatology 2013; 52 (9):
1635–41.
- Alijotas-Reig J, Ferrer-Oliveras R, Ruffatti A, Tincani A,
Lefkou E, Bertero MT, et al. (EUROAPS Study Group
Collaborators). The European Registry on Obstetric
Antiphospholipid Syndrome (EUROAPS): A survey of 247 consecutive
cases. Autoimmn Rev 2015; 14 (5): 387–95.
- Haram K, Svendsen E, Abildgaard U. The HELLP syndrome:
Clinical issues and management. A Review. BMC Pregnancy and
Childbirth 2009; 9 (1): 8–23. doi: 10.1186/1471-2393-9-8.
- Ganesan C, Maynard SE. Acute kidney injury in pregnancy: the
thrombotic microangiopaties. J Nephrol 2011; 24 (5): 554–63.
- Machado S, Figueiredo N, Borges A, Sao Jose Pais M, Freitas
L, Moura P. Acute kidney injury in pregnancy: a clinical
challenge. J Nephrol 2012; 25 (1): 19–30.
- Vafaeimanesh J, Nazeri A, Hosseinzadeh F. Plasmapheresis: a
lifesaving treatment in severe cases of HELLP syndrome. Caspian
J Intern Med 2014; 5 (4): 243–7.
- Erkurt MA, Berber I, Berktas HB, Kuku I, Kaya E, Koroglu M,
et al. A life-saving therapy in Class I HELLP syndrome:
Therapeutic plasma exchange. Transfus Apher Sci 2015; 52 (2):
194–8.
- Ganesan C, Maynard SE. Acute kidney injury in pregnancy: the
thrombotic microangiopaties. J Nephrol 2011; 24 (5): 554–63.
- Simetka O, Klat J, Gumulec J, Dolezalkova E, Salounova D,
Kacerovsky M. Early identification of women with HELLP syndrome
who need plasma exchange after delivery. Transfus Apher Sci
2015; 52 (1): 54–9.
- Erkurt MA, Berktas HB, Kuku I, Kaya E, Koroglu M, Nizam I,
et al. A life-saving therapy in Class I HELLP syndrome:
Therapeutic plasma exchange. Transfus Apher Sci 2015; 52 (2):
194–8.
- Kavanagh D, Goodship TH, Richards A. Atypical Hemolityc
Uremic Syndrome. Semin Nephrol 2013; 33 (6): 508–30.
- NorisM, Remuzzi G. Overview of Complement Activation and
Regulation. Semin Nephrol 2013; 33 (6): 479–92.
- Fakhouri F, Roumenina L, Provot F, Sallee M, Caillard S,
Couzi L, et al. Pregnancy-Associated Hemolytic Uremic Syndrome
Revisited in the Era of Complement Gene Mutations. J Am Soc
Nephrol 2010; 21 (5): 859–67.
- Sculy M, Goodship T. How I treat thrombotic thrombocytopenic
purpura and atypical haemolityc uraemic syndrome. Br J Hematol
2014; 164 (6): 759–66.
- Petrović D, Čanović P, Mijailović Ž, Popovska-Jovičić B,
Jaćović S. Hemolitičko-uremijski sindrom: etiopatogeneza,
dijagnostika i osnovni principi lečenja. Med Čas 2015; 49 (2):
DOI: 10.5937/mckg49-9121.
- Schwartz J, Winters JL, Padmanabhan A, Balogun RA, Delaney
M, Linenberger ML, et al. Guidelines on the Use of Therapeutic
Apheresis in Clinical Practice-Evidence-Based Approach from the
Writing Committee of the American Society for Apheresis: The
Sixth Special Issue. J Clin Apher 2013; 28 (3): 145–284.
- Cataland SR, Wu HM. How I treat: the clinical
differentiation and initial treatment of adult patients with
atypical hemolytic uremic syndrome. Blood 2014; 123 (16):
2478–84.
- Verhave JC, Wetzels JFM, van de Kar NCAJ. Novel aspect of
atypical haemolytic uraemic syndrome and the role of eculizumab.
Nephrol Dial Transplant 2014; 29 (Suppl 4): 131–41.
- De Sousa-Amorim E, Pelicano MB, Quintana LF, Campistol JM.
Eculizumab in pregnancy-associated atypical hemolytic uremic
syndrome: insights for optimizing management. J Nephrol 2015; 28
(5): 641–5.
- Zuber J, Fakhouri F, Roumenina LT, Loirat C, Fremeaux-Bacchi
V on behalf of the French Study Group for aHUS/C3G. Use of
eculizumab for atypical haemolytic uraemic syndrome and C3
glomerulopathies. Nat Rev Nephrol 2012; 8 (11): 643–57.
- Keating GM. Eculizumab: A Review of Its Use in Atypical
Haemolytic Uraemic Syndrome. Drugs 2013; 73 (18): 2053–66.
- Tsai HM. Pathophysiology of thrombotic thrombocytopenic
purpura. Int J Hematol 2010; 91 (1): 1–19.
- Fakhouri F, vercel C, Fremeaux-Bacchi V. Obstetric
Nephrology: AKI and Thrombotic Microangiopathies in Pregnancy.
Clin J Am Soc Nephrol 2012; 7 (12): 2100–6.
- Sayani FA, Abrams CS. How I treat refractory thrombotic
thrombocytopenic purpura. Blood 2015; 125 (25): 3860–7.
- Scully M, Thomas M, Underwood M, Watson H, Langley K,
Camilleri RS. Thrombotic thrombocytopenic purpura and pregnancy:
presentation, management, and subsequent pregnancy outcomes.
Blood 2014; 124 (2): 211–9.
- Chakravarty EF, Murray ER, Kelman A, Farmer P. Pregnancy
outcomes after maternal exposure to rituximab. Blood 2011; 117
(5): 1499–506.
- Nachman P, Glassock RJ. Crescentic glomerulonephritis. In:
Treatment of Primary Glomerulonephritis. Ponticelli C, Glassock
RJ. Eds. New Yoork: Oxford University Press 2009; 399–434.
- Hellmark T, Segelmark M. Diagnosis and classification of
Goodpasture,s disease (anti-GBM). J Autoimmun 2014; 48–49:
108–12.
- Dammacco F, Battaglia S, Gesualdo L, Racanelli V.
Goodpasture,s disease: A report of ten cases and a review of the
literature. Autoimmun Rev 2013; 12 (11): 1101–8.
- Greco A, Rizzo MI, De Virgilio A, Gallo A, Fusconi M,
Pagliuca G, et al. Goodpastures syndrome: A clinical update.
Autoimunn Rev 2015; 14 (3): 246–53.
- KDIGO Clinical Practice Guideline for Glomerulonephritis.
Anti-glomerular basement membrane antibody glomerulonephritis.
Kidney Int Supll 2012; 2 (2): 240–2.
- Greenhall GHB, Salama AD. What is new in the management of
rapidly progressive glomerulonephritis? Clin Kidney J 2015; 8
(2): 143–150.
- Thomson B, Joseph G, Clark WF, Hladunevic M, Patel A, Blake
P, et al. Maternal, pregnancy and fetal outcomes in de novo
anti-glomerular basement membrane antibody disease in pregnancy:
a systematic review. Clin Kidney J 2014; 7 (5): 450–6.
- Acharya A, Santos J, Linde B, Anis K. Acute Kidney Injury in
Pregnancy-Current Status. Adv Chronic Kidney Dis 2013; 20 (3):
215–22.
- Van Hook JW. Acute kidney injury during pregnancy. Clin
Obstet Gynecol 2014; 57 (4): 851–61.
- Petrović D. Akutno oštećenje bubrega: etiologija,
dijagnostika i lečenje.Medicinska Istraživanja 2011; 45 (3):
7–13.
- Kalantari K. The Choice of Vascular Access for Therapeutic
Apheresis. J Clin Apher 2012; 27 (3): 153–9.
- Greinacher A. Heparin-Induced Thrombocytopenia. N Engl J Med
373 (3): 252–61.
- Lee GM, Arepally GM. Diagnosis and Management of
Heparin-Induced Thrombocytopenia. Hematol Oncol Clin North Am
2013; 27 (3): 541–63.
- Arepally GM, Ortel TL. Heparin-Induced Thrombocytopenia.
Annu Rev Med 2010; 61 (1): 77–90.
- Pusey CD, Levy JB. Plasmapheresis in Immunologic Renal
Disease. Blood Purif 2012; 33 (1–3): 190–8.
- Kaplan A. Complications of Apheresis. Semin Dial 2012; 25
(2): 152–8.
Shema 1. Lečenje akutne trombotične trombocitopenijske purpure u
trudnoći.
Figure1. Management of thrombotic thrombocytopenic purpura in
pregnancy.
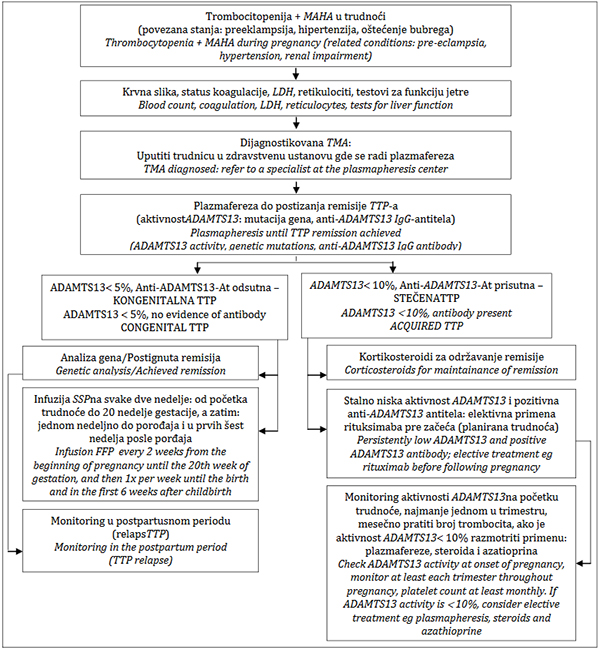
Prilagođeno prema Scully i sar. [45].
Modifedfrom Scully et al. [45].
Legenda: MAHA – mikroangiopatska hemolitička anemija; LDH –laktat
dehidrogenaza; TMA – trombotička mikroangiopatija; TTP – trombotička
trombocitopenijska purpura; SSP – sveže smrznuta plazma;
Legend: MAHA - microangiopathic haemolitic anaemia; LDH – lactate
dehydrogenase ; TMA – thrombotic microangiopathy; TTP – thrombotic
thrombocytopenic purpura; FFP –fresh frozen plasma;
Zahvalnost: Autori izražavaju najdublju
zahvalnost Ministarstvu nauke i tehnološkog razvoja Republike Srbije
za projekat N0175014, čija su sredstva korišćena kao jedan od izvora
za finansijsku podršku ove studije.
Acknowledgments: Authors would like to express their deepest
gratitude to the Serbian Ministry of Science and Technological
Development for their Grant N0175014, which was used as one of the
sources to financially support the study.
|
|
|
|

