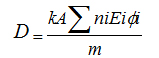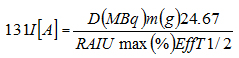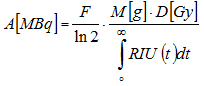| |
|
|
ISTORIJSKI PODACI
Priča o radiojodidu počinje još 1934. godine, kada je Enriko
Fermi na Kraljevskom Univerzitetu u Rimu pronašao novih 14 elemenata
jednostavnijim postupkom nego što je do tada to činio bračni par
Žolio Kiri, a što je objavljeno iste godine u časopisu Nejčer. Jedan
od tih novih elemenata bio je J131. Danas poznajemo 37 izotopa
127J53, a izotopi 123J, 124J, 125J, 127J, 129J, 131J su neki koji se
koriste u medicinske svrhe [1, 2, 3].
Ideja da se radioaktivni jod upotrebi za ispitivanje štitaste žlezde
javila se 12. novembra 1936, za vreme svečanog ručka koji je na
harvardskom Medicinskom fakultetu upriličio dr Karl Kompton,
predsednik Tehnološkog instituta u Masačusetsu (TIM). Tema skupa
bila je „Šta fizika može da učini za biologiju i medicinu”. Kada je
grupa lekara tom prilikom postavila pitanje o radioizotopima joda,
Kompton im je predočio Fermijem rad. Jedan od prisutnih lekara bio
je i Sol Herc, upravnik Klinike za štitastu žlezdu Opšte bolnice u
Masačusetsu.
Sol Herc i Artur Roberts (fizičar TIM) su prve eksperimente na
štitastoj žlezdi zečeva izveli radioizotopom J128, koji ima
poluvreme raspada od 25 minuta i malu aktivnost. Rezultate su
objavili krajem 1937. Bila je to prva studija o vezivanju
radiojodida u tireoideji. Pri eksperimentu je uočeno da vezivanje
radiojodida u tireoideji zavisi od količine unetog stabilnog joda.
4. novembra 1940, lekar i fizičar, prvi put primenjuju ciklotronski
proizvod J130 u lečenju žene sa hipertireozom. Njena tireoideja je
po njihovoj proceni vezivala 80% radiojodida.
Herc je u maju 1941. na sastanku američkog Društva za klinička
istraživanja predstavio rezultate 8 osoba lečenih izotopom J130.
Prosečna aplikovana aktivnost je bila 144 MBq (55- 240 MBq), a, da
bi izbegao pogubne efekte tireotoksikoze, pacijentima je davao
velike količine stabilnog joda. Autori ove studije su 3 meseca posle
aplikacije radiojodida zaključili da je bilo i izlečenih i
neizlečenih pacijenata.
11. maja 1946, kad je rat već bio završen, zbog kojeg je morao da
prekine svoj rad sa radiojodidnom terapijom i pacijente ostavi svom
saradniku Čepmanu, Herc uspeva da objavi u časopisu JAMA rezultate
koji pokazuju da je od 29 lečenih pacijenata, 21 postao eutireoidan.
Slične rezultate kao i Hercove objavljuje u istom broju istog
časopisa i Čepman. Jedina razlika je bila u tome što Čepman nije
koristio stabilni jod u saniranju efekata postradiojodidne
tireotoksikoze.
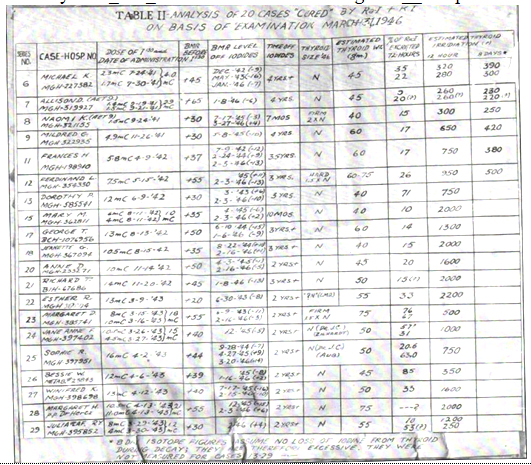
Slika 1. Originalna tabela dr Sola Herca sa prvih
29 pacijenata lečenih 131J (preuzeto sa
http://saulhertzmd.com/yahoo_site_admin/assets/docs/HistVignette__complete031.215110704.pdf).
Komisija za Atomsku energiju Sjedinjenih Država je posle Drugog
svetskog rata dozvolila upotrebu fisionih produkata u medicinske
svrhe. Pošto se pokazalo da izotop131J ima bolje fizičke osobine, da
ne nosi značajniji rizik od sekundarnih maligniteta i da je njegova
proizvodnja jeftinija u odnosu na proizvodnju 130J, upravnik
Medicinskog odeljenja Opšte bolnice u Masačusecu, prof. Hauard Minsk
zauzima stav da je radioaktivni jod najbolji lek za Grejvsovu
bolest.
RADIOJODID U TIREOIDEJI
Tireoidni klirens joda je 50ml/min. Klirens radiojodida je
obrnuto srazmeran unosu stabilnog joda. 90% oralno unetog
radioaktivnog joda se u prvom satu resorbuje u početnim delovima
tankog creva, a iz ekstracelularnih prostora se eliminiše
akumulacijom u tireoideji i izlučivanjem putem bubrega. U distalnim
tubulima Henleove petlje se reapsorbuje 75%, te se mokraćom izluči
40-70%, a fecesom 10%. J131 se nakuplja u pljuvačnim žlezdama,
sluznici želuca, horioidnom pleksusu, posteljici i žlezdanom tkivu
dojke.
Veći deo ciklotronski dobijenog joda je izotop 130J, a svega 10% je
131J. Razlike u fizičkim osobinama ova dva terapijska izotopa joda
su sledeće: 131J ima vreme poluraspada 8,04 dana, a 130J 0,525 dana;
oba izotopa emituju ß česticu: njen domet u vodi je kod 131J 2,2mm,
a srednja energija 0,191keV, dok ß čestica 130J ima domet od 4,2 mm,
a srednju energiju od 0,27MeV. Manja energija zračenja, duži
poluživot i manja prodornost u tkivu (manje radijaciono razaranje
tkiva) čine 131J pogodnijim za terapijsku upotrebu [1, 4].
Benigne bolesti štitaste žlezde koje se danas leče radiojodidom su:
- Grejvs-Bazedovljeva (GB) bolest (difuzna toksična autoimuna
struma);
- Plamerova bolest (jedan ili više hipersekretujućih autonomnih
fokusa);
- netoksična struma;
- subklinička hipertireoza (biohemijski definisana kao perzistentno
nizak nivo TSH uz normalne nivoe T4 i T3 u krvi).
Indikacije za terapijsku primenu radiojodida su:
- GB bolest, kod koje nije postignuta trajna remisija godinu dana
posle lečenja antitireoidnim lekovima;
- Plamerova bolest – ovo je terapija izbora jer primena
antitireoidnih lekova nema efekta;
- netoksična struma, ako pacijent ima tegobe kao što su dispnea ili
disfagija, a hirurška intervencija nosi prevelik rizik;
- subklinička hipertireoza može biti jedna od indikacija s obzirom
da ovi pacijenti imaju povećan rizik od atrijalne fibrilacije i
smrti uzrokovane kardiovaskularnim događajem. Zato postoji opšta
saglasnost (potekla iz USA) da bi lečenje radiojodidom trebalo
razmotriti kod ovakvih pacijenata.
Apsolutne kontraindikacije za primenu radiojodida su trudnoća
bolesnice, dojenje i spora akumulacija 131J. Relativne
kontraindikacije su veliki čvorovi ili velika struma. Iako postoji
strah da će edem tireoideje, koji se dešava prvog dana od aplikacije
radiojodida, dovesti do ugušenja, to se u praksi nije dogodilo čak
ni kod velikih multinodoznih retrosternalnih struma. Zato je
veličina žlezde relativna kontraindikacija.
Kada se govori o leku, uvek se postavlja pitanje odgovarajuće doze
za postizanje željenog terapijskog efekta. Doza, u fizičkom smislu,
jeste količina energije koju apsorbuje jedinica mase (J/kg = Gy).
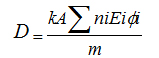
D – doza,
A – aktivnost 131J,
niEi – broj čestica sa energijom Ei koja se emituje po
nuklearnoj tranziciji,
m – masa tireoideje,
Φi – frakcija energije apsorbovana u mm.
Za određivanje doze 131J se koriste metode koje se zasnivaju na
procenjenoj masi tireoideje, na njenoj sposobnosti da akumulira
radiojodid, kao i na vremenu njegovog zadržavanja u štitastoj
žlezdi. U upotrebi su Marineli-Kvimbijev metod, metod interne
radijacione doze, metod Internacionalne komisije za radiološku
zaštitu.
Marinelijev metod je najčešće i najduže korišćen metod, dok se danas
savetuje izračunavanje aplikovane doze metodom Internacionalne
komisije za radiološku zaštitu.
Marinelijeva formula:
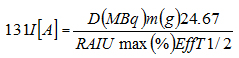
A – aktivnost 131J,
D – doza ciljnog tkiva,
m – masa tireoideje,
RAIU – brzina akumulacija 131J u tireoideji,
Eff T1/2 – efektivni poluživot J131u žlezdi.
Formula koju za računanje aktivnosti za datu dozu preporučuje
Evropska asocijacija nuklearne medicine (EANM) jeste [5]:
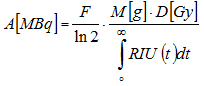
A – aktivnost 131J,
F – faktor konverzije,
M – masa tireoideje,
D – doza za ciljno tkivo,
RIU – brzina akumulacija 131J u tireoideji.
Postojanje brojnih načina za izračunavanje adekvatne doze
radiojodida kao leka ukazuje da još uvek ne postoji idealan način.
Dosadašnji pristupi su manjkavi zbog neopravdanog očekivanja da su
masa tireoideje i njena sposobnost da veže i zadrži 131J jedine
veličine koje utiču na dozu. Bez obzira na aplikovanu dozu, lečeni
pacijenti ipak, na kraju, postanu hipotireoidni. Zato se kao krajnji
cilj terapije ne postavlja eutireoidno stanje, već hipotireoidizam
koji se kontroliše preparatima levotiroksina. Hipotireozu je lakše
lečiti nego tireotoksikozu izazvanu navedenim entitetima.
Pri ovakvim načinima računanja terapijske doze (aktivnosti),
radijacioni rizik od apsorbovane doze je ipak precenjen, što u
krajnjem slučaju može da dovede do aplikacije manje doze nego što je
pacijentu neophodno za izlečenje. Postoje dva koncepta određivanja
konačne doze: koncept ablativne („fiksne”) doze i koncept
„individualne” doze. Večita je dilema koji je od njih bolji.
Koncept ablativne doze preporučuje dozu od 250Gy koja u 90%
lečenih pacijenata dovodi do eutireoze ili hipotireoze. Doze od 60Gy
do 150Gy daju velik procenat eutireoidnih stanja, ali i povećan broj
osoba koje zahtevaju aplikaciju nove doze. Kod pacijenata sa GB
bolešću, naročito kod onih koji su razvili i tireoidnu orbitopatiju,
preporučuje se doza od 300Gy koja brzo destruiše tireoideju i uvodi
pacijenta u hipotireoidno stanje. Za pacijente sa autonomnim
toksičnim čvorom preporučuju se doze od 300Gy do 400Gy s kojim je
uspešnost terapije i do 90%.
Koncept „individualne” doze podrazumeva određivanje
aktivnosti 131J za svakog pacijenta ponaosob [6]. Studija Pitersa i
dr. je pokazala da su kod individualno računatih aktivnosti 131J
pacijenti primali doze od 50Gy do 150Gy, iako je aktivnost računata
da se postigne doza od 100Gy. Srednja primljena doza je bila 119Gy.
Terapija je bila „ravnomernije” uspešna (hipotireoza) u grupi
ovakvih GB bolesnika, u odnosu na masu tireoideje. Pacijenti kojima
je bila namenjena „fiksna” aktivnost od 555MBq primili su srednju
dozu od 208Gy. Terapija je u ovoj grupi bolesnika bila uspešnija kod
osoba sa manjom žlezdom. Autori, ipak, zaključuju da ni „fiksna” ni
„individualna” doza ne eliminišu GB na zadovoljavajući način, ali
zagovaraju upotrebu individualne doze. Poređenje terapijskog uspeha
različitih fiksnih doza nije pokazalo statistički značajnu razliku
među njima [7, 8].
Ne postoji idealan test koji može da predvidi klinički odgovor na
ozračivanje, uključujući i ono koje potiče od 131J. Efekat na
tireocite proizvode β čestice koje prelazeći put od 1-2mm u tkivu i
oštećuju ne samo hromozome tireocita, već i drugih ćelija. Pokazalo
se da aktivnosti od 111MBq/kg do 2,037GBq/kg tkiva izazivaju sledeće
radijacione efekte: prvog dana uočljiv je periglandularni edem sa
infiltracijom limfocitima, polimorfonuklearnim ćelijama i mast
ćelijama. Drugog dana štitasta žlezda postaje eozinofilna masa sa
prepoznatljivim folikulima samo u perifernim delovima, a trećeg dana
prisutna dolazi do potpune destrukcije tireoideje. Ove oštećene
ćelije se vremenom eliminišu, a potpun oporavak od β čestičnog
zračenja 131J se postiže posle 24 meseca [9]. Interesantno je da
upotreba nekih supstanci, kao što je ekstrakt ginkobilobe,
neutrališe genotoksični efekat 131J kod pacijenata sa GB bolešću i
pri tom ne remeti klinički ishod.
Radiojodidna terapija dovodi do ireparabilnog oštećenja DNK i
inicira destruktivne procese u tkivu štitaste žlezde koji na kraju
dovode do kliničkog cilja: smanjenja tireoidne funkcije i/ili njene
veličine. Dugo vremena posle terapije histološki se nalaze
adenomatozni čvorovi sa cističnim promenama (promene na oksifilnim
ćelijama), kao i različit stepen hroničnog tireoiditisa.
Tireoidna ošamućenost (thyroid stunning) je fenomen pri kojem je
preuzimanje radiojodida štitastom žlezdom smanjeno zbog prethodnog
ozračivanja jonizujućim zračenjem. Ovaj fenomen se javlja u vezi sa
smanjenim nivoom natrijum-jodidnog simportera (NIS) i sa znacima
prekida ćelijskog ciklusa. Pojava je primećena i pri veoma malim
ozračivanjima (0,15Gy), odnosno zavisi od vrste radioizotopa i doze
ozračivanja i nije vezana za ćelijsku smrt. Interesantno je da
spoljnje ozračivanje povećava nakupljanje radiojodida u zavisnosti
od doze, bez obzira na usporenu ćelijsku proliferaciju koja se pri
tom dešava. Efekat „ošamućenosti” tireoideje ima značaja i kod
terapije benignih bolesti štitaste žlezde, naročito pri
ponavljanjima aplikacija doza u GB bolest jer se javlja i pri malim
dozama ozračivanja. U toku prvih sati posle prve aplikacije
terapijskog radiojodida započinje „samoošamućivanje”, koje može biti
odloženo i do 2 dana, a pojačava se u sledeće 3 do 4 nedelje, i,
čini se, sasvim nestaje posle četiri nedelje od primene radiojodidne
terapije [1].
Efekti radiojodidne terapije se procenjuju merenjem nivoa TSH i
slobodne frakcije T4 u krvi, najranije posle 2 nedelje, a optimalno
posle 2 meseca od primene 131J [6]. Test brzine akumulacije
radiojodida u štitastoj žlezdi, takođe, može da se koristi za
procenu efekta terapije kod osoba sa toksičnim adenomom. U ovom
slučaju, popravljaju se inicijalno niske vrednosti testa i dostižu
vrednosti fiziološkog opsega.
Danas se trajna hipotireoza smatra željenim efektom terapije kod
svih bolesnika lečenih radiojodidom. Ona se dešava različitom
brzinom, kod različitih osoba (u prvim mesecima posle aplikacija
131J ili za 5, 10 ili više godina), ali se desi kod svih lečenih
osoba. U međuvremenu lečene osobe su eutireoidne.
U 3% do 20% slučajeva javlja se prolazna hipotreoza, definisana kao
porast serumskog nivoa TSH i/ili nizak nivo tireoidnih hormona.
Teško ju je predvideti, češća je kod pacijenata kod kojih je brzina
akumulacije posle 2 sata bila veća od 70%, a vrlo je retka kod
pacijenata lečenih dozama većim od 370MBq. Ako je TSH na prvoj
postterapijskoj kontroli veći od 45mIJ/L, malo je verovatno da je
hipotireoza prolazna.
Mehanizmi nastanka prolazne hipotireoze su nejasni: ili je reč o
imunološkom odgovoru, ili se radi o smanjenom broju funkcijskih
tireocita. Kada se hipotireoza javi posle radijodidne terapije kod
tireotoksičnog adenoma, malo je verovatno da je prolazna, te se
supstituciona terapija preparatima levotiroksina može uvesti bez
odlaganja.
DA LI RADIOJODIDNA TERAPIJA IMA NEŽELJENE EFEKTE?
Neželjeni postterapijski efekti se mogu javiti u vezi sa
funkcijom tireoideje, sa njenom veličinom, kao imunološki odgovor, i
kao posledica ekstratireoidnog ozračivanja.
Studija sa 7209 hipertireoidnih pacijenata, koji su lečeni
radioaktivnim jodom između 1950. i 1989, pokazala je povećanu
smrtnost zbog tireoidnih, kardiovaskularnih i cerebrovaskularnih
bolesti, kao i pojavu preloma kostiju u prvoj godini po terapiji.
Druga studija je pokazala povećanu smrtnost od kardiovaskularnih
bolesti za 12%, a takav trend se nastavio i sledećih 35 godina.
Ostaje, ipak, nejasno da li je takav trend posledica
preegzistirajuće tireoidne bolesti ili same radiojodidne terapije
[10, 11].
Stopa izlečenja radiojodidnom terapijom je obrnuto srazmerna
dvadesetčetvoročasovnoj fiksaciji. Ovo se objašnjava brzim obrtom
joda u hipermetaboličkim tireocitima: ovakvi tireociti proizvode
veću količinu vodonik-peroksida (H2O2) koja je neophodna za sintezu
tireoidnih hormona. Smanjenje tireocitnog metabolizma menja
intraćelijsku ravnotežu između stvaranja slobodnih radikala i
odbrane od istih, što čini da tireocit postane radiosenzitivniji.
FAKTORI KOJI UTIČU NA RADIOJODIDNU TERAPIJU
Uzrast i pol
Ne može se sa sigurnošću proceniti uticaj uzrasta i pola na RJ
terapiju. Postoje podaci koji ukazuju da je dečja tireoideja
radiorezistentnija u odnosu na adultnu štitastu žlezdu. S druge
strane, studije ukazuju na obrnutu povezanost uzrasta i ishoda
terapije, podržavajući mišljenje da je mlađa tireoideja
radiosenzitivnija. Muški pol je povezan sa gorim ishodom terapije,
dok se postterapijska hipotireoza češće javlja kod žena.
Veličina štitaste žlezde
Preterapijska veličina tireoideje može da bude nezavisan prediktor
uspeha RJ terapije. Studije uglavnom potvrđuju obrnutu povezanost
između preterapijske veličine (zapremine žlezde) i postterapijskog
smanjena iste. Rad Muru-Netoa i dr. je pokazao da je terapija kod
žlezde od 62g i manjih, oko 7 puta uspešnija nego u većih žlezda [1,
12].
Tireoidna antitela
Antireceptorska-TSH antitela su visoko specifični i senzitivni
marker GB bolesti. Neke studije su pokazale povezanost pojave
postterapijske hipotireoze sa postterapijskim porastom ovih i
antitiroidno-stimulišućih antitela.
Kortikosteroidi
Kortikosteroidi u velikim dozama smanjuju poluživot 131J, te mogu da
oslabe efekte terapije.
Antitireoidni lekovi
Metaanaliza 14 randomiziranih kliničkih studija je potvrdila da
upotreba antitireoidnih lekova (ATL) smanjuje terapijske efekte
radiojodida, bez obzira u kom periodu se primenjivala: pre RJ
terapije, za vreme ili posle RJ terapije. Takođe se pokazalo da je
rizik od hipotireoze smanjen ako se ATL daju za vreme ili posle
aplikacije J131. Ovi lekovi utiču na biokinetiku J131 i ne bi
trebalo zanemariti ovu činjenicu ako ne želimo da bolesnik primi
manju dozu nego što je potrebno za njegovo izlečenje. Prekid
terapije ATL 2 dana pre aplikacije J131 povećava primljenu dozu za
50% jer povećava „fiksaciju” i produžava radiojodni poluživot.
Biokinetika 131J u tireoideji je, zbog prisustva ATL,
nepredvidljiva, a samim tim i efekti radiojodidne terapije. ATL,
blokiranjem organifikacije joda, menjaju veličinu folikulskog
epitela, veličinu samog folikula, te na taj način utiču i na efekte
terapije. Neke studije pokazuju da PTU ima dugotrajniji
radioprotektivni efekat u odnosu na metimazol (čak i do 55 dana, po
jednom istraživanju). Pokazalo se, takođe, i da vreme bez ATL dobro
korelira sa stopom izlečenja radijodidom.
Lečenje multinodularne toksične strume AT lekovima povećava rizik od
postterapijskog hipotireoidizma zbog „fenomena krađe” (steal
phenomena) jer lek utiče samo na zdravo perinodularno tkivo
štitnjače.
Pušenje
Dobro je poznata povezanost pušenja sa bolestima štitaste žlezde.
Pušači imaju 3,3 puta veću šansu da razviju GB bolest u odnosu na
nepušače. Sa prestankom pušenja nestaje i ovaj rizik. Pušenje
povećava i rizik od TO (tireoidne orbitopatije), nezavisno od rizika
koji za TO nosi sama GB bolest. Zato se kod ovakvih bolesnika pre RJ
terapije započinje preventivna terapija kortikosteroidima. Pušenje
nosi i povećan rizik od strume u oblastima siromašnim jodom. U
oblastima sa dovoljnom količinom joda, ovakav rizik ne postoji. Ne
zna se kako pušenje utiče na izlečenje radiojodidom, niti kako utiče
na smanjenje tireocita kod netoksičnih struma [1].
Drugi faktori
Litijum blokira oslobađanje joda iz tireoideje, smanjuje sintezu
tireoidnih hormona i povećava poluživot 131J u štitastoj žlezdi. Ovo
je idealna situacija za RJ terapiju jer se povećava radijaciona
doza, a smanjuju efekti postterapijske tireotoksikoze.
Rekombinantni humani TSH značajno stimuliše tireocite i unos joda,
povećavajući broj natrijum-jodnog simportera na njihovoj bazalnoj
membrani. Primena rhTSH ima mnogo veći značaj u postoperativnoj
evaluaciji pacijenata sa diferentovanim karcinomom štitaste žlezde,
nego kod RJ terapije benignih tireoidnih bolesti.
Diuretici stimulišu izlučivanje brojnih minerala, pa i joda. Ovo bi
moglo poboljšati „fiksaciju” RJ u tireoideji jer se smanjuje put
stabilnog joda u organizmu. Ipak, diuretici se ne koriste za
poboljšanje RJ terapije, ni kod karcinomskih, ni kod benignih
tiroidnih bolesti.
PRIMENA RADOJODIDA U CENTRU ZA NUKLEARNU MEDICINU KLINIČKOG
CENTRA SRBIJE
Lečenje benignih tireoidnih bolesti je u Srbiji počelo pre 54
godine. Za to vreme lečeno je više od 5460 pacijenata. Način
aplikacije 131J se nije menjao do danas, a blisko sledi principe
koje je postavio Sol Herc.
Najveći broj od 3027 pacijenata Centra za nuklearnu medicinu KCS,
evaluiranih povodom proslave 50 godina nuklearne medicine u Srbiji,
jesu žene sa GB bolešću, njih 1426. Od 477 muškaraca, od GB je
lečeno 275. Od toksičnog adenoma je lečeno 576 osoba, 474 žene i 102
muškarca; od strume, 654 osoba, 563 žene i 91 muškarac. 96
pacijenata je lečeno radiojodidom iz „drugih” razloga, kao što je
subklinička hipertireoza. Samo jednu dozu u toku lečenja primilo je
2045 žena, odnosno 505 muškaraca, a sa dve i više doza lečeno je 355
žena, odnosno 122 muškarca. Hipertireoza je kod žena trajala u
proseku 4,9 godina, a kod muškaraca 4,2 godine, pre nego su primili
131J.
Konačna odluka lekara (specijaliste nuklearne medicine) da se
aplikuje terapijski radiojodid donosi se na osnovu testa brzine
akumulacije radiojodida u štitastoj žlezdi. Prethodno pripremljen
pacijent per os unosi kapsulu ili rastvor J131 u aktivnosti od
1,85MBq. Pacijent se priprema na sledeći način: obustavi se terapija
ATL (tiamazol ili propiltiouracil) na dve nedelje pred planiranu
aplikaciju radiojoda. Osigura se da pacijent namirnicama ne unese
preveliku količinu stabilnog joda (stabilnog joda ima u ekscesu u
mineralnim vodama („Minakva”), orahovači, zelenim oraščićima
potopljenim u medu, aroniji, u lekovima kao što je amjodaron hlorid,
u antisepticima (polivinilpirolidon jod), u radiološkim kontrastnim
sredstvima). Količina radioaktivnog joda koja se nakupila u
tireoideji meri se za to dizajniranom sondom 3 sata, odnosno 24 sata
posle njegovog unošenja. Opseg fizioloških vrednosti za teren Srbije
iznosi 7% do 20% od unete aktivnosti 131J posle 3 sata, odnosno 27%
do 45% posle 24 sata. Vrednosti veće od navedenih ukazuju da je
žlezda „spremna” da primi 131J u terapijske svrhe. Izuzetak je
Plamerova bolest u kojoj se zbog veličine autonomnog hiperaktivnog
čvora ne očekuje povećan obrt 131J u tireoideji (perinodularno
suprimovano tkivo, tj. „zdravo” tkivo ne vezuje 131J).
Terapijska aktivnost radiojodida se u Centru za nuklearnu medicinu
KCS određuje individualno prema svakom pacijentu, a na osnovu mase
štitaste žlezde, veličine dvadesetčetvoročasovne „fiksacije” 131J, u
cilju da se masi od g tireoideje aplikuje aktivnost od 37 kBq do
44kBq. Masa štitaste žlezde se približno procenjuje palpacijom. Na
prvi kontrolni pregled pacijent se poziva posle 3 meseca od
aplikacije radiojodida jer se smatra da je to optimalno vreme za
analizu krvi na TSH i fT4. Konačan efekat terapije se procenjuje za
godinu dana. Rezultati Centra za nuklearnu medicinu KCS pokazuju da
je prve godine posle aplikacije terapijske aktivnosti 131J bilo
eutireoidnih 1274 pacijenta (1079 žena, 195 muškaraca).
Hipotireoidnih je bilo 929 osoba (786 žena i 143 muškarca).
Slika 2. Terapijska lista pacijenta lečenog
radioaktivnim jodom.

ZAKLJUČAK
Iskustvo lekara Centra za nuklearnu medicinu KCS u lečenju
benignih bolesti štitaste žlezde radiojodidom kod više od 5460
pacijenata potvrđuje još jednom efikasnost, bezbednost i
jednostavnost primene ove vrste terapije.
LITERATURA
- Bonnema S, Hegedüs L. Radioiodine therapy in benign thyroid
diseases: effects, side effects, and factors affecting
therapeutic outcome. Endocr Rev. 2012; 33: 920-80.
- Silberstein EB. Radioiodine: the classic theranostic agent.
Semin Nucl Med. 2012; 42: 164 -70.
- Hertz B. Saul Hertz, MD (1905-1950): A Pioneer in the Use of
Radioactive Iodine. Endocr Pract [serial on the on the Internet]
2010 July/August [cited 2014 august 15]; 16 (4): [about 3 p.]
Available from:
http://saulhertzmd.com/yahoo_site_admin/assets/docs/HistVignette__complete031.215110704.pdf
- Han R. Lečenje Grejvsove bolesti radioaktivnim jodom.
Glasnik [cited 2014 august 15]; [about 4p.] Avaiable from:
http://www.cigota.rs/sites/default/files/Document4.pdf
- Stokkel MP, Handkiewicz Junak D, Lassmann M, Dietlein M,
Luster M. EANM procedure guidelines for therapy of benign
thyroid disease. Eur J Nucl Med Mol Imaging. 2010; 37: 2218-28.
- Royal College of Physicians. Radioiodine in the management
of benign thyroid disease: clinical guidelines. Report of a
Working Party. London: RCP, 2007. Avaiable from:https://www.rcplondon.ac.uk/sites/default/files/documents/radioiodine-management-benign-thyroid-disease.pdf
- Peters H, Fischer C, Bogner U, Reiners C, Schleusener H.
Radioiodine therapy of Graves' hyperthyroidism: standard vs.
calculated 131iodine activity. Results from a prospective,
randomized, multicentre study. Eur J Clin Invest. 1995; 25:
186-93.
- Santos RB, Romaldini JH, Ward L. A randomized controlled
trial to evaluate the effectiveness of 2 regimens of fixed
iodine (¹³¹I) doses for Graves disease treatment. Clin Nucl Med.
2012; 37: 241-4.
- Soley M, Foreman N. Radioiodine therapy in Graves’ disease.
J. Clin Invest 1949; 28: 1367–1374.
- Franklin J, Maisonneuve P, Sheppard MC, Betteridge R and
Boyle P. Mortality after the Treatment of Hyperthyroidism with
Radioactive Iodine. N Engl J Med 1998; 338: 712-718.
- Metso S, Auvinen A, Salmi J, Huhtala H, Jaatinen P Increased
long-term cardiovascular morbidity among patients treated with
radioactive iodine for hyperthyroidism. Clin Endocrinol (Oxf).
2008; 68: 450-7.
- Moura-Neto A, Mosci C, Santos AO, Amorim BJ, de Lima MC,
Etchebehere EC, et al. Predictive factors of failure in a fixed
15 mCi 131I-iodide therapy for Graves' disease. Clin Nucl Med.
2012; 37: 550-4.
|
|
|
|