| |
|
|
UVOD
Proučavanje crevne mikrobiote čoveka i njegove uloge u raznim
bolestima značajno je napredovalo u poslednjoj deceniji. Mikrobiotu
čoveka čine svi mikroorganizmi koji žive u simbiozi s ljudskim
telom, a mikrobiom predstavlja skup svih gena mikrobiote.
Humani mikrobiom sadrži i do stotinu puta veći broj gena negoli
ljudski genom. Mikroorganizme možemo naći u raznim delovima ljudskog
tela, ali najbrojnija je mikrobiota organa za varenje. Mikrobiota je
varijabilna među zdravim ljudima i jedinstvena za pojedinca - ne
postoje dva ista mikrobioma kod ljudi, kao što ne postoje ni isti
otisci prstiju. Iako ne postoje dva čoveka sa istim sastavom
mikrobiote, ipak, postoje veće sličnosti u sastavu mikrobiote među
pripadnicima istih rasa, etničkih grupa i osoba u krvnom srodstvu.
Crevna mikrobiota je skup od približno 1014 mikroorganizama. Broj
bakterija u svakom čoveku je veći od broja ljudi koji su ikada
živeli na zemlji. To je zajednica desetostruko brojnija od svih
ćelija našeg organizma. Sastoji se od bakterija (oko 1000 različitih
vrsta), arheja, gljivica, virusa i parazita koji čine jedinstveni
ekosistem. Mikrobiota ima veoma važnu ulogu za čovekovo zdravlje. Od
ključne je važnosti za održavanje homeostatskih funkcija
gastrointestinalnog trakta, jer učestvuje u procesima varenja
domaćina, metabolizmu i regulaciji crevnog imunog sistema [1,2]. Po
rođenju, digestivni trakt novorođenčeta nije naseljen
mikroorganizmima. U prvim satima života ga kolonizuju majčini
mikroorganizmi, u početku koliformne bakterije i streptokoke,
kasnije laktobacili i enterokoke, a broj mikroorganizama u crevnom
traktu počinje da se povećava, postepeno formirajući dinamičku
ravnotežu crevne mikrobiote. Naravno, porast ovih bakterija zavisi i
od načina porođaja - prirodni ili carskim rezom [3]. U odrasloj
dobi, većina crevne mikrobiote sastoji se od pet grupa mikroba, a
to su: Bacteroidetes, Firmicutes, Actinobacteria, Proteobacteria i
Cerrucomicrobia. Približno je proporcionalni broj Gram-pozitivnih
Firmicutes i Gram-negativnih Bacteroidetes koje čine većinu vrsta u
zdravom odraslom crevu > 90% [4-5]. Odnos Firmicutes i Bacteroidetes
ostaje relativno konstantana kod zdrave jedinke, iako nije jednak
kod svih pojedinaca. Razlike nastaju zbog razlika u genomima
domaćina, faktorima okoline kao što su higijena, prehrana, način
života i upotreba antibiotika [4]. Zbog kiselog okruženja i
intenzivne peristaltike, u želucu i dvanaestopalačnom crevu je
prisutno manje mikroorganizama (10–1000 / ml), od kojih su većina
gram-pozitivne bakterije. Enterokoke i Laktobacili su prisutni u
dvanaestopalačnom crevu, a broj bakterija u ovom području je obično
104/ ml. Brojem i raznolikošću vrsta najbogatije je debelo crevo
(1012/ ml), koje je pretežno naseljeno gram-negativnim i anaerobnim
bakterijama [5].
Šta je tačno zdrava mikrobiota nije do kraja razjašnjeno, ali je
pokazano da u slučaju narušene ravnoteže - disbioze, može doći do
razvoja bolesti. Кada prehrambene navike, faktori okoline, crevna
infekcija, neki lekovi ili drugi faktori dovedu do promena u vrsti i
količini crevnih mikroorganizama, dolazi do disbioze creva, koja
uzrokuje zapaljenjske i metaboličke poremećaje. Homeostaza crevne
mikrobiote presudna je za održavanje ljudskog zdravlja, dok disbioza
doprinosi razvoju raznih bolesti, uključujući kardiovaskularne,
hronične bolesti bubrega, dijabetes tipa 2, nealkoholnu masnu jetru,
pa i neke vrste raka [1,6,7]. Disbioza creva može objasniti zašto su
neki pojedinci skloniji razvoju određenih bolesti. Promene u sastavu
mikrobiote nedavno su identifikovane kao važan faktor narušavanju
funkcionisanja „osovine crevo-srce“ što doprinosi razvoju
ateroskleroze i hipertenzije - dva glavna faktora rizika za razvoj
kardiovaskularnih bolesti [1,7,8].
slika 1. Uticaj Disbioze creva na kardiovaskularne
bolesti
(preuzeta sa sajta
https://www.thelancet.com/journals/ebiom/article/PIIS2352-3964(20)30024-4/fulltext
u naučne svrhe a ne koristi se u komercijalne svrhe)
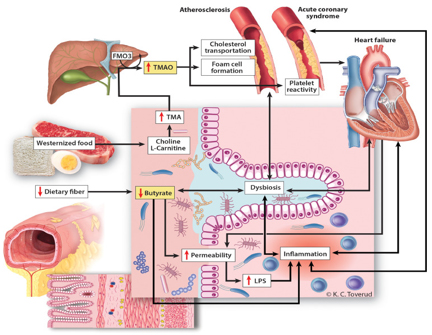
Mikrobiota creva se može smatrati endokrinim organom, a svaki
mikrob ima sposobnost da proizvede stotine različitih poznatih i
nepoznatih metabolita koji deluju dalje od samog creva. Kako većinu
bakterija koje nastanjuju organe za varenje za sada nije moguće
kolonizovati u laboratoriji, za utvrđivanje sastava mikrobiote
koriste se metoda sekvenciranja nove generacije i bioinformatičke
analize ekstrahovane mikrobne dezoksiribonukleinske kiseline (DNK).
Poslednjih godina proučavan je uticaj sastava mikrobiote na
različite hronične i autoimune bolesti, posebno u ispitivanjima na
životinjama [3,8]. Ova istraživanja pokazuju značaj mikrobiote u
odnosu na zdravlje i imunitet i nude nove, još neotkrivene
mogućnosti za upotrebu ovog znanja u lečenju nekih drugih bolesti,
poput metaboličkog sindroma, insulinske rezistencije , hroničnih
inflamatornih bolesti creva, karcinoma [1,6,9].
Disbioza creva i ateroskleroza
Ateroskleroza je glavni faktor rizika za kardiovaskularne bolesti.
Ovaj proces karakteriše akumulacija holesterola i makrofaga
(inflamatornih ćelija) u vaskularnim zidovima, što doprinosi
stvaranju ateroskleroskih plakova. Nedavne studije pokazale su da
crevna disbioza može da doprinese razvoju ateroskleroze
modulirajući zapaljenske procese i formirajući određene mikrobne
metabolite [10-15].
Integritet crevne sluznice je prva barijera koja štiti domaćina od
upada patogena, prolaska crevnog sadržaja i bakterijskih komponenata
u krvne sudove. Smanjena koncentracija proteina koji osiguravaju
bliske ćelijske kontakte i njihovu nepropusnost, uključujući
zonula occludens-1 (ZO-1) poznat i kao Tight junction protein-1
(TJP1), klaudin 1 i okludin, omogućava povećanu propustljivost
crevnog zida remeteći ravnotežu između odumiranja i regeneracije
mukoznih ćelija [1,13,14]. Ako je sluzna barijera oštećena, prodor
mikroba i njihovh produkata u krvne sudove pokreće imuni odgovor,
tkivno i sistemsko zapaljenje. Oštećenje integriteta crevne barijere
izazvano crevnom disbiozom, dakle, deluje kao faktor rizika koji
pokreće hronično zapaljenje koje leži u u osnovi različitih bolesti
uključujući i aterosklerozu. Glavni molekuli-produkti bakterija koji
su i pokretači imunog i zapaljenjskog odgovora su „patogeni povezani
sa molekularnim obrascima“ (engl. Pathogen-associated molecular
pattern- PAMP). PAMP-ovi aktiviraju urođeni imunološki odgovor,
štiteći domaćina od infekcije Širok spektar različitih vrsta
molekula može da služi kao PAMP, uključujući glikane i
glikokonjugate. Bakterijski lipopolisaharidi (LPS), endotoksini koji
se nalaze na ćelijskim membranama gram negativnih bakterija,
smatraju se prototipskom klasom PAMP-a. Povezanost nivoa LPS u
plazmi i kardiovaskularnog rizika prvi put su proučavali 1999.
godine Niebauer i saradnici [15]. Rezultati studije potvrdili su da
je nivo endotoksemije bio najveći kod pacijenata sa najtežom
kardiovaskularnom bolešću. Cani i saradnici potvrdili su u svojoj
studijida je crevna disbioza sprečila stvaranje „proteina bliskog
kontakta“, što je rezultiralo povećanjem propustljivosti sluzokože
creva, a samim tim i prolazom LPS u krv [16]. LPS, koji se proizvode
u povećanim količinama u crevnoj disbiozi, mogu igrati važnu ulogu
u modulaciji „receptora sličnih putarini“ (Toll-like receptors-TLR)
koji prepoznaju bakterijske proizvode i regulišu imunološki sistem
domaćina. TLR su klasa proteina koji igraju ključnu ulogu u
urođenom imunološkom sistemu. Oni su jednokratno prolazni membranski
receptori koji se obično nalaze na sentinel ćelijama (ćelije prve
linije odbrane) poput makrofaga i dendritičnih ćelija koje
prepoznaju strukturno očuvane molekule izvedene iz mikroba. Jednom
kada mikrobi probiju fizičke barijere poput kože ili sluznice
crevnog trakta, prepoznaju ih TLR-ovi, koji aktiviraju reakcije
imunih ćelija. Kliničke studije su pokazale da je porast TLR
povezan sa antiinflamatornom aktivnošću i promoviše razvoj
ateroskleroze kod ljudi. Rezultati ovih istraživanja poslednjih
godina time potvrđuju ulogu i značaj crevne mikrobiote i disbioze u
riziku od ateroskleroze [8,9,10,17] .
U metabolizmu crevnih bakterija nastaju različiti metaboliti koji
učestvuju u razvoju ateroskleroze. Među najvažnijim su različiti
amini, metilamini, poliamini, masne kiseline kratkog lanca,
trimetilamin i sekundarne žučne kiseline. Konkretno, masne kiseline
sa kratkim lancem (SCFA - Short-chain fatty acid) su grupa crevnih
mikrobnih metabolita koji su važni za metaboličke bolesti. Studije
su pokazale da je crevna mikrobiota uključena u stvaranje
trimetilamin N-oksida (TMAO) [8,14]. Trimetilamin (TMA) je
nusprodukt bakterijskog metabolizma koji se apsorbuje u krvotok i
pretvara u TMAO u jetri pomoću specifičnih jetrenih enzima,
monooksigenaza koje sadrže flavin. Različiti bakterijski sastavi
prirodno imaju različite sposobnosti da formiraju TMAO. Studije na
miševima su potvrdile da TMAO ubrzava razvoj ateroskleroze
stimulisanjem priliva holesterola, inhibicijom izlučivanja
holesterola, inhibicijom metabolizma sekundarnih žučnih kiselina i/
ili prekomernom aktivacijom trombocita [3,8,10]. Prema
istraživačima, pored uloge biološkog markera za aterosklerozu i
kardiovaskularne bolesti, TMAO bi mogao da predstavlja i mogući
terapijski cilj u budućnosti Zanimljivo je da su razvijeni
inhibitori proizvodnje TMAO koji ciljaju različite mikrobne TMA
liaze. Ovi lekovi smanjuju nivo TMAO i preokreću aterosklerozu na
životinjskim modelima. TMA liaza je postala trenutni potencijalni
terapijski cilj TMAO modulacije [18].
Mikrobiota creva i hipertenzija
Osim dislipidemije i ateroskleroze, hipertenzija je još jedan od
najvažnijih faktora rizika za KVB koji je genetski osetljiv i pod
uticajem faktora okoline [19]. Još 1982. godine pokazano je da
lečenje antibioticima može prouzrokovati viši krvni pritisak [15].
Sa druge strane, jedan niz studija pokazao je povoljan efekat
korišćenja antibiotika na krvni pritisak. Ovi podaci, kao i uočena
veza između disbioze i cerebrovaskularnih događaja je indirektno
upućivalo na vezu između mikrobiote creva i hipertenzije koja je
procenjivana u novijim studijama [20,21]. Dalje, kod spontano
hipertenzivnih pacova dokumentovano je da dolazi do značajnog
smanjenja broja i raznolikosti mikroba u crevima i smanjenja broja
cekalnih „dobrih bakterija“ iz vrste Bacteroidetes, što je praćeno
proporcionalnim povećanjem broja „loših bakterija“ iz vrste
Firmicutes. Studije su, takođe, pokazale da transplantacija cekalnog
mikrobiološkog sadržaja od hipertenzivnih životinja davaoca može
reprodukovati hipertenziju kod prethodno normotenzivnih životinja
[22]. U studiji na miševima pokazano je da disbioza crevne
mikrobiote može da izazove angiotenzin-II-indukovanu vaskularnu
disfunkciju i hipertenziju. Kao što je u drugom istraživanju
utvrđeno da odsustvo crevne mikrobiote štiti miševe od arterijske
hipertenzije indukovane angiotenzinom II, vaskularne disfunkcije i
oštećenja krajnjih organa izazvanih hipertenzijom [23,24].
Dakle, očigledno je da je mikrobiota creva uključena u razvoj ili
pogoršanje hipertenzije. Iako tačni osnovni mehanizmi i međusobna
veza između mikrobiote creva i hipertenzije nisu utvrđeni,
postojeći dokazi iz istraživanja na životinjama i kliničkih studija
ističu ulogu masnih kiselina kratkog lanca -SCFA i oksidisanog
lipoproteina male gustine (ox-LDL) u nastanku hipertenzije. Masne
kiseline kratkog lanca poput acetata, proprionata i butirata,
nastaju uglavnom iz polisaharida rastvorljivih dijetalnih
vlakana[23]. Grupe mikroba u crevima koje metabolizuju polisaharide
u različite vrste SCFA su specifične. Glavne bakterije koje
proizvode acetat su Streptococcus, Prevotella, Bifidobacterium,
Clostridiums i A. Muciniphila [25]. Propionate generišu Bacteroides,
Salmonella, Dialister, Veillonella, Roseburia, Coprococcus, Blautia,
i dr. [26]. Butirate stvaraju Lachnospiraceae, Ruminococcac, i Acid
amino coccaceae [27]. Suplementacija vlakana i acetata dovodi do
povećanja broja Bacteroides acidifaciens i bila je povezana sa
poboljšanjem crevne disbioze, hipertenzije i srčane insuficijencije
kod hipertenzivnih miševa [28]. Preveliki broj bakterija koje
proizvode butirat povezan je sa povišenim sistolnim i dijastolnim
krvnim pritiskom kod trudnica [29].
G protein vezani receptori (GPCR) su receptori na ćelijskoj
površini koji otkrivaju molekule SCFA izvan ćelije i aktiviraju
ćelijske odgovore. Tri GPCR-a koja su regulisani SCFA-om su: GPR41,
GPR43 i GPR109A [30]. SCFA stimulišu puteve regulisane GPCR-om da
utiču na sistem renin-angiotenzin da modulira krvni pritisak.
Olfaktorni receptor 78 (Olfr78) je još jedan tip GPCR-a eksprimiran
u bubregu koji detektuje SCFA[31]. I Olfr78 i GPR41 su izraženi u
ćelijama glatkih mišića krvnih sudova malog prečnika. U drugoj
studiji, stimulacija GPR41 rezultirala je smanjenjem hipotenzivnog
odgovora [32]. SCFA, propionat indukuje vazodilataciju i proizvodi
akutni hipotenzivni odgovor kod miševa modulacijom aktivnosti Olfr78
i GPR41 [33]. Svi ovi nalazi otkrivaju da mikrobiota creva igra
važnu ulogu u modulaciji krvnog pritiska preko SCFA i upućuje da je
hipertenzija povezana sa disbiozom.
Pored izmenjene regulacije različitih receptora preko SCFA, crevna
disbioza, takođe, doprinosi hipertenziji vazokonstrikcijom
posredovanom oksidacijom LDL [34]. Mikrobna disbioza promoviše
ekspresiju pro-inflamatornih citokina i indukuje oksidativni stres
koji stimuliše oksidaciju LDL [35]. Viši nivoi oksidisanog LDL
(Ox-LDL) smanjuju proizvodnju NO, smanjuju stepen vazodilatacije i
stimulišu stvaranje vazokonstriktornih supstanci među kojima je i
endotelin-1 koji igra presudnu ulogu u održavanju vaskularnog tonusa
i kardiovaskularne homeostaze. Narušena ravnoteža dovodi do
hipertenzije [35]. Ipak, uzročni odnos između disbioze creva i
hipertenzije je složen i nije u potpunosti procenjen. Tačna uloga
crevne mikrobiote u posredovanju hipertenzije, uključeni putevi i
mehanizmi zahtevaju dalja detaljna istraživanja.
Crevna mikrobiota i srčana insuficijencija
Sve je više dokaza o povezanosti mikrobiote creva i patogeneze
srčane insuficijencije. U engleskoj literaturi se za definisanje ove
veze koristi izraz „crevna hipoteza srčane insuficijencije“ - “gut
hypothesis of heart failure” [36-39]. Ova hipoteza objašnjava da
smanjeni minutni volumen srca (MVS) i povećana sistemski zastoj
mogu prouzrokovati crevnu ishemiju i/ili edem crevnog zida, što
dovodi do povećanog prodiranja bakterija u krvne sudove,
povećavajući tako koncentraciju endotoksina u cirkulaciji. To može
pokrenuti upalu kod pacijenata sa srčanom insuficijencijom. Egzogeni
faktori kao što su dijeta, izloženost bakterijskim infekcijama ili
uzimanje lekova mogu smanjiti raznolikost crevne flore. Endogeni
faktori kao što su akutna humoralna neravnoteža, hronična crevna
kongestija odnosno ishemija-hipoksija, kiselinsko-bazni disbalans,
oslabljena gastrointestinalna pokretljivost i nutritivni nedostatak
mogu potencijalno promeniti crevnu floru [40]. Sa razvojem srčane
insuficijencije, menjaju se i karakteristike zajednice bakterija.
Studije su pokazale da se brojnost crevne flore kod pacijenata sa
hroničnom srčanom insuficijencijom smanjila, a broj patogenih
bakterija značajno se povećavao sa napredovanjem bolesti,
uključujući Campilobacter, Shigella, Salmonella, Iersinia
enterocolitica i Candida vrste [41,42,43]. Analiza 16SrRNA kod
pacijenata sa srčanom insuficijencijom izvestila je o smanjenju
bakterija koje proizvode SCFA, kao što su Eubacterium rectale i
Dorea longicatena [43]. Druga studija je pokazala da se sastav
mikrobiote creva kod hronične srčane insuficijencije odlikuje
smanjivanjem broja bakterija sa potencijalom za proizvodnju butirata
[44]. Butirat vrši lokalne antiinflamatorne efekte u sluznici creva
i stimuliše regulatorne T-ćelije [45]. Primećeno je da je brojnost
mikrobioloških gena za LPS biosintezu i stvaranje TMAO povišena, a
gena za butirat acetoacetat koenzim A transferaze (ključni enzim za
proizvodnju butirata) smanjena u hroničnoj srčanoj insuficijenciji
[41].
Primećeno je, takođe, da su pacijenti sa srčanom insuficijencijom i
sa perifernim edemima imali viši nivo endotoksina i inflamatornih
citokina u plazmi u poređenju sa pacijentima bez edema.Nakon
kratkotrajne terapije diureticima, koncentracije endotoksina u
serumu, ali ne i citokina, su se smanjile[46]. U drugoj studiji
istraživači su potvrdili da su pacijenti sa srčanom insuficijencijom
i smanjenim crevnim protokom krvi imali veće serumske koncentracije
imunoglobulina A - anti-lipopolisaharida. U poređenju sa kontrolnom
grupom, pacijenti su imali drugačiji sastav mikrobiote, broj
korisnih bakterija se smanjio, a patogenih povećao [24]. Pojava i
razvoj srčane insuficijencije mogu biti povezani sa smanjenjem
bakterija koje proizvode SCFA i porastom bakterija koje proizvode
TMAO, što može postati nova meta za lečenje srčane insuficijencije.
Nedavno su prikazani efekti inhibitora enzima trimetilamin liaze
koji u studijama na miševima pokazuju učinak sličan dejstvu
anti-aterotrombotičkih agenasa. [47,48].
Mikrobiota creva i infarkt miokarda
Aterosklerotični plakovi sadrže bakterijsku DNK. Vrste bakterija
koje se nalaze u aterosklerotskim plakovima, međutim, prisutne su i
u crevima istih pojedinaca [18,19,36]. Studija iz Južne Koreje
pokazuje da je tokom akutne faze STEMI u koronarnom trombu
detektovano prisustvo bakterija (mikrobna rRNA). Mikrobiološki
potpis u koronarnom trombu pokazao je korelaciju sa oralnim i
crevnim mikrobiomom [20]. Iz ovoga se može zaključiti da crevne
mikrobne zajednice mogu biti izvor bakterija u plaku, što može
uticati na stabilnost plaka i razvoj kardiovaskularnih bolesti.
Nedavno istraživanje na pacovima izvestilo je o povezanosti između
crevne mikrobiote i obima infarkta miokarda [38,39]. Studija je
proučavala Dahl S pacove (Dahl Salt Sensitive Rat- pacovi hranjeni
hranom sa visokim sadržajem soli - 8% NaCl) koji su pili vodu za
piće uz dodatak antibiotika vankomicina, koji je smanjio nivo
cirkulišućeg leptina za 38%, prouzrokovao po obimu manji infarkt
miokarda (smanjenje površine od 27%) i poboljšao obnavljanje
postishemijske kontraktilnosti miokarda u poređenju sa kontrolnim
životinjama koje nisu dobijale antibiotik. Vankomicin je izmenio
obilnost crevnih bakterija i gljivica mereno količinom 16S i 18S
rRNA [39].
U studijama na glodarima, primena Lactobacillus plantarum kao
probiotika rezultirala je smanjenjem cirkulišućeg leptina za 41%,
infarktom miokarda za 29% i boljim oporavkom kontraktilne funkcije
miokarda za 23%. Međutim, ako su glodari pre studije primili leptin
u dozi od 0,12 µg / kg i.v. zaštitni efekat probiotika na srce je
bio poništen. Ova studija je prva koja je potvrdila direktnu vezu
između promena crevne mikrobiote i infarkta miokarda. To pokazuje da
dodatak probiotika može smanjiti stepen infarkta miokarda [46].
Druga studija na životinjskom modelu koja je koristila Lactobacillus
rhamnosus pokazala je povoljan efekat na srčanu funkciju nakon
veštački izazvanog infarkta miokarda [49].
Mikrobiota creva i metaboličke bolesti
Mnoga istraživanja pokazuju vezu između sastava crevne mikrobiote i
metaboličkih poremećaja u organizmu [50,51,52]. Uloga mikrobiote
creva u razvoju gojaznosti dokazana je studijama sprovedenim na
obeskličenim miševima (germfree-GF-miševi) u poređenju sa
konvencionalno gajenim miševima (CONV-R). Sterilni miševi bez klica
se uzgajaju u izolatorima koji u potpunosti blokiraju izloženost
mikroorganizmima, sa namerom da ih sačuvaju od otkrivenih bakterija,
virusa i eukariotskih mikroba. CONV-R imaju 40% veći sadržaj
telesne masti od GF-miševa, što je fenomen nezavisan od unosa hrane.
Međutim, nakon kolonizacije GF-miševa crevnom florom koja dolazi od
CONV-R miševa, uočen je značajan porast telesne težine i ~ 60%
porast telesne masti, zajedno sa povećanom sintezom jetrenih
triglicerida u primaocima fekalnog transplantata (GF miševi),
nezavisno od unosa hrane i ukupne potrošnje energije [53]. Čini se
da je mehanizam putem kojeg crevni mikrobi doprinose povećanoj
apsorpciji energije stvaranjem kratkolančanih masnih kiselina
(SCFA), što je rezultat hidrolize i fermentacije dijetalnih
polisaharida. SCFA, kao što su propionat, butirat i acetat, vrše
složene metaboličke akcije koje utiču na apetit domaćina, vreme
crevnog tranzita, apsorpciju i taloženje masti [52]. SCFA, takođe,
povećavaju unutrašnju apsorpciju monosaharida stimulišući
ekspresiju transportera natrijuma/glukoze 1. SCFA doprinose
modulaciji apetita domaćina i unosu hrane u interakciji sa
G-vezanim proteinima eksprimiranim enteroendokrinim ćelijama i
promovišu oslobađanje glukagona sličnog peptida-1 (GLP-1) koji utiče
na sitost. Pored toga, SCFA utiču na metabolizam lipida
povećavajući lipogenezu i inhibirajući oksidaciju masnih kiselina
[53]. Studije su dokazale specifične promene u sastavu mikrobiote
creva kod genetski gojaznih miševa u poređenju sa genetski mršavim
miševima, pokazujući smanjenje obilja Bacteroidetes-a za 50% i
proporcionalno povećanje Firmicutes-a. Čini se da ove specifične
promene doprinose povećanoj proizvodnji SCFA i nagomilavanju masti
kod gojaznih miševa i kod GF miševa kolonizovanih mikrobiotom
gojaznih miševa [54]. Postoje i drugi mogući mehanizmi. Dijeta sa
visokim sadržajem masti pokazala je da povećava udeo
gram-negativnih vrsta u mikrobioti creva, što doprinosi povećanoj
apsorpciji crevnih fragmenata bakterija, poput lipopolisaharida
(LPS) u crevima. Povećani nivoi LPS u cirkulaciji dovode do
„metaboličke endotoksemije“ koja se manifestuje kao povećanje
telesne težine, hiperglikemija natašte i hiperinsulinemija [55]. Sve
je više dokaza koji ukazuju na to da dijeta sa visokim sadržajem
masti promoviše promene u sastavu mikrobiote creva, ali je kasniji
razvoj gojaznog fenotipa povezan sa metaboličkom endotoksemijom
[56].
Poslednjih godina istraživači su, takođe, proučavali veze između
disbioze i gojaznosti, dijabetesa tipa 2, dislipidemije i
nealkoholne masne jetre (NASH) [50,51]. Početna ispitivanja na
životinjama i ljudima podržala su povezanost između gojaznosti i
obilja grupe bakterija Firmicutes u poređenju sa grupom
Bacteroidetes; dijabetes tipa 2, međutim, povezan je sa smanjenim
obiljem bakterija koje formiraju butirat i povećanim obiljem
Lactobacillus spp [1,3,8,10]. Crevna mikrobiota je uključena u
razvoj dislipidemija putem sekundarnih žučnih kiselina [52,53]. U
istraživanju NASH-a utvrđeno je da neke bakterije (Clostridium
coccoides, Lactobacillus reuteri, Parabacteroides) utiču na
metabolizam masti, integritet crevnog zida i proces fibroze i tako
utiču i na dislipidemiju [52].
Primena u praksi
Primeri kliničke korisnosti dugotrajne promene mikrobiote su:
dijetetske mere, pre- i probiotička terapija, antibiotska terapija,
unos ciljanih inhibitora enzima, fekalna mikrobna transplantacija
itd. [57,58].
Istraživanja su pokazala da čak i petodnevna promena u ishrani
dovodi do kratkotrajnog preuređivanja broja i vrsta crevnih mikroba
[4]. Primer za to je prehrambeni pristup za zaustavljanje
hipertenzije (DASH dijeta -Dietary Approaches to Stop Hypertension)
koji se sastoje od obroka sa voćem, povrćem, integralnim
žitaricama itd. [59]. Pacijenti u studiji na ovoj dijeti su pokazali
poboljšanje kvaliteta života i bolju elastičnost arterijskih krvnih
sudova nakon tri meseca pridržavanja mera [60]. Pored toga, opisano
je da osobe koje se ne pridržavaju propisane dijete i imaju
„zapadnjačku dijetu“ sa dosta masti i crvenog mesa imaju povišeni
nivo TMAO u urinu u poređenju sa pacijentima koji se pridržavaju
propisanog DASH režima [61,62]. Smanjen unos dijetalnih vlakna
povezan je sa smanjenom bakterijskom proizvodnjom butirata masnih
kiselina kratkog lanca, koji ima imuno-modulacione efekte u sluznici
creva, a takođe služi i kao glavni energetski supstrat za
kolonocite. Smanjenje nivoa butirata u crevima moglo bi da podstakne
lokalnu upalu, pogorša disbiozu i doprinese oštećenju funkcije
crevne barijere, što posledično dovodi do „curenja“ bakterijskih
toksina kao što je LPS, što dodatno podstiče lokalnu i sistemsku
upalu. Dijeta bogata vlaknima može poboljšati rast bakterija koje
proizvode acetat, smanjiti visok krvni pritisak i sprečiti srčanu
fibrozu i hipertrofiju [63].
Probiotici i prebiotici
Probiotici su živi mikroorganizmi koji, kada se daju u
odgovarajućim količinama, domaćinu donose zdravstvenu korist [
64]. Probiotici u kliničkoj upotrebi sadrže bakterijske i gljivične
mikroorganizme, uključujući rodove Lactobacillus i Bifidobacterium
i gljivicu Saccharomices boulardii [65]. Rezultati životinjskih
modela sugerišu da bi određeni sojevi laktobacila mogli imati
kardioprotektivne efekte. Pacovi lečeni suplementom koji sadrži
Lactobacillus plantarum 299v pre podvezivanja koronarne arterije
smanjili su veličinu infarkta i poboljšali funkciju leve komore
[66]. Druga studija pokazala je slične kardioprotektivne rezultate
na pacovskom modelu ishemije miokarda nakon suplementa sa
Lactobacillus rhamnosus GR-1 [67]. Pilot studija na ljudima
izvestila je ne samo o smanjenom sistemskom zapaljenju, već i o
poboljšanju ejekcione frakcije leve komore nakon intervencije sa
probiotičkim kvasnicama Saccharomices Boulardii kod pacijenata sa
hroničnom srčanom insuficijencijom [68]. S obzirom na potencijalni
klinički uticaj modulacije mikrobiota, kao i visok morbiditet i
mortalitet od srčane insuficijencije, modulacija mikrobiote nije
potpuno bez rizika [69]. Preporučuje se brižno kliničko praćenje i
unapred definisane mere bezbednosti koje treba da slede iste
standarde kao u drugim kliničkim ispitivanjima [70]. Ovo stoga što
su nedavno prijavljeni genomski i epidemiološki dokazi o
bakteriemiji probiotskih bakterija, odnosno o prenosu bakterija sa
probiotičkih kapsula u krv kod pacijenata u jedinicama intenzivne
nege [71].
Prebiotici su supstrati koje mikroorganizmi domaćina selektivno
koriste i daju potencijalnu korist za zdravlje. Kao prebiotici
najčešće se koriste dijetalna vlakna i oligosaharidi [72]. Većina
savremenih studija obrade mikrobiote kod pacijenata sa
kardiovaskularnim bolestima izveštava o iscrpljivanju mikroba sa
kapacitetom stvaranja SCFA kao što je butirat. Prebiotici koji
promovišu mikrobiološku fermentaciju dijetalnih vlakana u SCFA mogu
stoga biti od potencijalne koristi u poboljšanju metaboličke
regulacije [73]. Neki prebiotici, poput inulina, imaju potencijal da
se suprotstave štetnim efektima antibiotika promovišući raznolikost
i funkcionalni kapacitet crevne mikrobiote [74]. Randomizovana
studija sa suplementom hrane inulinom ili inulin-proprionatnim
estrom pokazala je smanjenje markera sistemske upale sa povećanim
generisanjem SCFA proprionata u debelom crevu [75]. Stoga su
ciljanje proizvodnje mikrobioloških SCFA dodacima inulina ili drugih
prebiotika atraktivna strategija za buduća ispitivanja
kardiovaskularnih bolesti, mada trenutni naučni dokazi ne daju
potvrđene preporuke za upotrebu probiotika ili prebiotika kao
dopunske terapije kod pacijenata sa srčanom insuficijencijom ili
koronarnom bolešću.
Antibiotici. Upotreba antibiotika utiče na sastav, raznovrsnost i
funkciju normalne flore [76]. Antibiotici su uspešno korišćeni na
životinjskim modelima za smanjenje stepena oštećenja srčanih
ćelija nakon infarkta miokarda [77,78]. Ranije studije kod
pacijenata sa srčanom insuficijencijom, fokusirale su se na
dekontaminaciju creva antibioticima širokog spektra radi smanjenja
translokacije biotoma i bakterijske upale. Iako je ovaj pristup
uspeo u smanjenju markera sistemske upale, klinički efekat nije
dokazan [79,80]. U nedavnoj studiji je pokazano da je koktel oralnog
antibiotika širokog spektra znatno povećao postinfarktnu rupturu i
smrt u mišjem modelu ligacije koronarne arterije [81] što bi moglo
da sugeriše da je za pravilan oporavak miokarda potrebna netaknuta
mikrobna zajednica u vreme povrede miokarda. Ova studija je u
suprotnosti sa prethodnim životinjskim eksperimentalnim modelom koji
je pokazao da je oralni vankomicin smanjio veličinu infarkta i
poboljšao postinfarktnu srčanu funkciju kod pacova [82], kao i sa
studijom koja izveštava da je mešavina streptomicina, neomicina,
polimiksina B i bacitracina smanjila veličinu infarkta zajedno sa
promenama u metabolitima povezanim sa mikrobiotom [83]. Bez obzira
na razlike, ove studije na životinjama snažno ukazuju na ulogu
sastava mikrobiote creva u akutnom infarktu miokarda, ali smer
promena mikrobiote i potencijalni metabolički ili inflamatorni
putevi još nisu dobro poznati. Modifikovanje kardiovaskularnih
bolesti antibiotskom terapijom nije nova ideja. Između 1995. i 2005.
godine> 19 000 pacijenata bilo je uključeno u studiju lečenja
pneumonije kod pacijenata sa koronarnom bolešću. Studija kod ovih
bolesnika nije pokazala kliničku korist od antibiotske terapije u
vezi sa koronarnom ishemijom [84]. Pored očiglednog rizika od
antimikrobne rezistencije, nedavno su se pojavili i drugi sigurnosni
problemi sa potencijalnim značajem za buduća ispitivanja. Nedavno
je desetogodišnje praćenje pokazalo povećanu kardiovaskularnu smrt
kod pacijenata sa stabilnom koronarnom bolešću koji su lečeni
klaritromicinom [85] što je dovelo do upozorenja FDA 2018. godine o
upotrebi klaritromicina kod pacijenata sa koronarnom bolešću. FDA
savetuje oprez pre propisivanja antibiotika klaritromicina
pacijentima sa srčanim oboljenjima zbog potencijalnog povećanog
rizika od srčanih problema ili smrti koji mogu nastupiti godinama
kasnije.
(https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-review-finds-additional-data-supports-potential-increased-long).
U decembru 2018. godine, objavljeno je upozorenje FDA o upotrebi
fluorohinolona ukazujući na mogućnost ruptura aorte i disekcije
aorte kod pacijenata sa povećanim rizikom, kao što su stariji
pacijenti sa hipertenzijom ili perifernom aterosklerotskom
vaskularnom bolešću
(https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-review-finds-additional-data-supports-potential-increased-long).
Još jedna studija izvestila je o povećanom riziku od
kardiovaskularnih događaja kod starijih žena sa povećanom
kumulativnom izloženošću antibioticima u odrasloj dobi [86].
Objašnjenje za ovaj povećani rizik nije do kraja kod svih
pacijenata poznato, ali bi moglo uključivati produženje
QT-intervala, aritmiju ili pro-inflamatorne aktivnosti posredovane
translokacijom mikrobiote creva, ili druge efekte posredovane
crevnom mikrobiotom. S obzirom na ove sigurnosne probleme i
nedostatak do kraja jasnog kliničkog efekta o učinku antibiotiotika
na mikrobiotu trebalo bi pojačati oprez u budućim studijama
usmerenim na upotrebu antibiotika kod kardiovaskularnih bolesnika.
Ciljani inhibitori enzima. Pored napred navedene upotrebe TMA liaze
[18] treba pomenuti rezultate studije u kojoj su miševi koristili
analoge holina koji inhibiraju dejstvo enzima u metabolizmu TMA i
time smanjuju koncentraciju TMAO u plazmi. Upotreba analoga holina
bi, prema tome, mogla da omogući novi pristup smanjenju rizika za
trombozu [69]. Još jedan zanimljiv aktivni sastojak koji deluje kao
zaštitni faktor za crevnu sluznicu je Urolitin A (UroA) i njegov
sintetički analog UAS03 koji poboljšavaju bliski ćelijski kontakt i
funkciju gastrointestinalne barijere [87].
Fekalna mikrobna transplantacija (FMT) je poslednjih godina među
najpominjanijim intervencijama koje se koriste za saniranje disbioze
creva. Uvođenje „dobrih “ bakterija uzetih od zdravih ispitanika u
gastrointestinalni trakt pacijenata koji pate od crevne disbioze i
njenih posledica je nova i efikasna terapijska strategija. U
kliničkoj studiji koja je ispitivala osobe sa metaboličkim sindromom
došlo je do značajno poboljšane osetljivost na insulin posle 6
nedelja FMT u kojoj su donori bili zdrave osobe osobe normalne
telesne težine. Istovremeno FMT je povećala količinu bakterija koje
proizvode butirat [88]. Iako je prihvatanje terapijske upotrebe FMT
sve prisutnije, kako zbog percepcije ove meteode kao „prirodnog“
lečenja i relativno jeftine primene, odnos rizika i koristi posebno
u bolestima KVS ostaje nedovoljno jasno definisan jer je objavljeno
iskustvo sa FMT ograničeno, a ni pravna normativa ove terapije još
nije precizno uređena. Dalje, postoji strah od zaraznog potencijala
terapije, što je navelo istraživače da istraže upotrebu proizvoda
„sintetičke stolice“ sa definisanom populacijom bakterija da bi
ublažili takve probleme, a razmatra se i upotreba „smrznutog
donorskog materijala nešto poput koncepta banke matičnih ćelija
[89].
Zaključak
Nova saznanja i tehnologije značajno menjaju medicinsku doktrinu
i omogućavaju novi, drugačiji pogled na telo, organe i zdravlje,
kao i na uzročne faktore bolesti. Istraživanja u nedavnoj prošlosti
i ponekad iznenađujući nalazi potvrdili su da crevna mikrobiota
može uticati na zdravlje domaćina i pokrenuti bolest različitim
patofiziološkim mehanizmima. Crevna mikrobiota i disbioza su
područja istraživanja koja će u budućnosti verovatno promeniti
neke danas uspostavljene metode prevencije i lečenja bolesti. Iako
možemo da promenimo sastav mikrobiote pomoću prebiotika,
probiotika, antibiotika, dijete i „ciljanih inhibitora enzima“,
zasad ne možemo predvideti i detaljno proceniti sve efekte ovih
intervencija u prevenciji različitih bolesti. Uz sve podatke
dobijene u biomedicini poslednjih decenija, čini se neobičnim da je
trebalo toliko vremena pre nego što su naučnici i kardiolozi počeli
sistematski da se bave uticajem 2kg mikroorganizama koji nas
kolonizuju i žive sa nama „u dobru i zlu“. Iako su predstavljeni
samo neki mehanizmi koji povezuju crevnu mikrobiotu i pojedine
kardiovaskularne bolesti, moramo biti svesni mogućnosti ovog
istraživačkog područja u razvoju potencijalnih lekova u budućnosti.
Novorazjašnjene veze između disbioze i patogeneze kardiovaskularnih
bolesti nude nove mogućnosti za rano i ciljano delovanje.
P.S. Možda će nova istraživanja dovesti i do nove subspecijalizacije
u internoj medicini koja će se (kako u svom predavanju na kongresu
Internista 2019. godine anegdotski reče prof. Miodrag Krstić) zvati
gastroenterokardiologija?
LITERATURA:
- Mengchao Jin Mengchao Jin, Zhiyuan Qian, Jiayu Yin, Weiting
Xu, and Xiang Zhou The role of intestinal microbiota in
cardiovascular disease Journal of Cellular and Molecular
Medicine 2019; 23(4): 2343–2350.
- Sekirov I, Russell SL, Antunes LC, Finlay BB. Gut microbiota
in health and disease. Physiol Rev. 2010;90(3):859-904. DOI:
10.1152/physrev.00045.2009 PMID: 20664075
- Tang WH, Kitai T, Hazen SL. Gut Microbiota in Cardiovascular
Health and Disease. Circ Res. 2017;120(7):1183-96. DOI:
10.1161/CIRCRESAHA.117.309715 PMID: 28360349
- David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE,
Wolfe BE, et al. Diet rapidly and reproducibly alters the human
gut microbiome. Nature. 2014;505(7484):559-63. DOI:
10.1146/annurev-med-060513-093205 PMID: 25587655
- Tamburini S, Shen N, Wu HC, Clemente JC. The microbiome in
early life: implications for health outcomes. Nat Med.
2016;22(7):713-22. DOI: 10.1038/nm.4142 PMID: 27387886
- Nallu A, Sharma S, Ramezani A, Muralidharan J, Raj D. Gut
microbiome in chronic kidney disease: challenges and
opportunities. Transl Res. 2017;179:24-37. DOI:
10.1016/j.trsl.2016.04.007 PMID: 27187743
- Tang WH, Wang Z, Levison BS, Koeth RA, Britt EB, Fu X, et
al. Intestinal microbial metabolism of phosphatidylcholine and
cardiovascular risk. N Engl J Med. 2013;368(17):1575-84. DOI:
10.1056/NEJMoa1109400 PMID: 23614584
- Ahmadmehrabi S, Tang WH. Gut microbiome and its role in
cardiovascular diseases. Curr Opin Cardiol. 2017;32(6):761-6.
DOI: 10.1097/HCO.0000000000000445 PMID: 29023288
- Yamashiro K, Tanaka R, Urabe T, Ueno Y, Yamashiro Y, Nomoto
K, et al. Gut dysbiosis is associated with metabolism and
systemic inflammation in patients with ischemic stroke. PLoS
One. 2017;12(2):e0171521. DOI: 10.1371/journal.pone.0171521
PMID: 28166278
- Vinod N. The Novel Dimensions of Cardio-Metabolic Health:
Gut Microbiota, Dysbiosis and its Fallouts. Curre Res Diabetes &
Obes J. 2019;11(1):555805. DOI: 10.19080/CRDOJ.2019.11.555805
- ANTAL, I., JELIĆ, M., SILA, S., KOLAČEK, S. i TAMBIĆ
ANDRAŠEVIĆ, A. LJUDSKA MIKROBIOTA I MIKROBIOM. Acta medica
Croatica, 2019;73(1),3-11. Preuzeto sa
https://hrcak.srce.hr/
- Lloyd-Price J, Abu-Ali G, Huttenhower C. The healthy human
microbiome. Genome Med 2016; 8 (1):51.
- Qi Y, Aranda JM, Rodriguez V, Raizada MK, Pepine CJ. Impact
of antibiotics on arterial blood pressure in a patient with
resistant hypertension - A case report. Int J Cardiol.
2015;201:157-8. DOI: 10.1016/j.ijcard.2015.07.078 PMID: 26301638
- Gomez-Arango LF, Barrett HL, McIntyre HD, Callaway LK,
Morrison M, Dekker Nitert M; SPRING Trial Group. Increased
Systolic and Diastolic Blood Pressure Is Associated With Altered
Gut Microbiota Composition and Butyrate Production in Early
Pregnancy. Hypertension. 2016;68(4):974-81. DOI:
10.1161/HYPERTENSIONAHA.116.07910 PMID: 27528065
- Niebauer J, Volk HD, Kemp M, Dominguez M, Schumann RR,
Rauchhaus M, et al. Endotoxin and immune activation in chronic
heart failure: a prospective cohort study. Lancet.
1999;353(9167):1838-42. DOI: 10.1016/S0140-6736(98)09286-1 PMID:
10359409
- Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D,
et al. Metabolic Endotoxemia Initiates Obesity and Insulin
Resistance. Diabetes. 2007;56(7):1761-72. DOI: 10.2337/db06-1491
PMID: 17456850
- Karlsson FH, Fåk F, Nookaew I, Tremaroli V, Fagerberg B,
Petranovic D, et al. Symptomatic atherosclerosis is associated
with an altered gut metagenome. Nat Commun. 2012;3(1):1245. DOI:
10.1038/ncomms2266 PMID: 23212374
- Wang Z. Roberts A.B. Buffa J.A. Levison B.S. Zhu W. Org E.
et al.Non-lethal inhibition of gut microbial trimethylamine
production for the treatment of therosclerosis.Cell.
2015;163:1585-1595.
- Townsend MK, Aschard H, De Vivo I, Michels KB, Kraft P
Genomics, telomere length, epigenetics, and metabolomics in the
nurses’ health studies. Am J Public Health 2016;106(9):
1663-1668.
- Ju Seung Kwun, Si-Hyuck Kang, Hyo-Jung Lee, Chang-Hwan Yoon,
Jung-Won Suh, Young-Seok Cho, METAGENOMIC ANALYSIS OF MICROBIOTA
IN PATIENTS WITH ST-SEGMENT ELEVATION MYOCARDIAL INFARCTION 2.
ORAL, GUT, AND THROMBUS MICROBIOME IN ST-SEGMENT ELEVATION
MYOCARDIAL INFARCTION 112JACC, 2020;75(11). Preuzeto 18.11.2020
sa
https://www.jacc.org/doi/pdf/10.1016/S0735-1097%2820%2930739-7
- Yamashiro K, Tanaka R, Urabe T, Ueno Y, Yamashiro Y, et al.
Gut dysbiosis is associated with metabolism and systemic
inflammation in patients with ischemic stroke. PLoS One
2017;12(2): e0171521.
- Honour J The possible involvement of intestinal bacteria in
steroidal hypertension. Endocrinology 1982;110(1): 285-287.
- Yang T, Santisteban MM, Rodriguez V, Li E, Ahmari N, et al.
Gut dysbiosis is linked to hypertension. Hypertension
2015;65(6):1331-1340.
- Karbach SH, Schonfelder T, Brandao I, Wilms E, Hörmann N, et
al. Gut microbiota promotes angiotensin II-induced arterial hy
pertension and vascular dysfunction. J Am Heart Assoc 2016;5(9):
e003698.
- Koh A, De Vadder F, Kovatcheva-Datchary P, Backhed F From
dietary fiber to host physiology: short-chain fatty acids as key
bacterial metabolites. Cell 2016;165(6): 1332-1345.
- Rey FE, Faith JJ, Bain J, Muehlbauer MJ, Stevens RD, et al.
Dissecting the in vivo metabolic potential of two human gut
acetogens. J Biol Chem 2010;285(29): 22082-22090.
- Louis P, Flint HJ Formation of propionate and butyrate by
the human colonic microbiota. Environ Microbiol 2017;19(1):
29-41.
- Duncan SH, Barcenilla A, Stewart CS, Pryde SE, Flint HJ
Acetate utilization and butyryl coenzyme A (CoA): acetate-CoA
transferase in butyrate-producing bacteria from the human large
intestine. Appl En- viron Microbiol 2002;68(10): 5186-5190.
- Gomez-Arango LF, Barrett HL, McIntyre HD, Callaway LK,
Morrison M, et al. Increased systolic and diastolic blood
pressure is associ- ated with altered gut microbiota composition
and butyrate production in early pregnancy. Hypertension
2016;68(4): 974-981.
- Marques FZ, Nelson E, Chu PY, Horlock D, Fiedler A, et al.
High-fiber diet and acetate supplementation change the gut
microbi- ota and prevent the development of hypertension and
heart failure in hypertensive mice. Circulation 2017;135(10):
964-977.
- Tan JK, McKenzie C, Marino E, Macia L, Mackay CR
Metabolite-sensing g protein-coupled receptors-facilitators of
diet-related immune regulation. Annu Rev Immunol 2017;35:
371-402.
- Pluznick JL, Protzko RJ, Gevorgyan H, Peterlin Z, Sipos A,
et al. Olfactory receptor responding to gut microbiota-derived
signals plays a role in renin secretion and blood pressure
regulation. Proc Natl Acad Sci U.S.A 2013;110(11): 4410-4415.
- Natarajan N, Hori D, Flavahan S, Steppan J, Flavahan NA, et
al. Microbial short chain fatty acid metabolites lower blood
pressure via endothelial G protein-coupled receptor 41. Physiol
Genomics 2016;48(11): 826-834.
- Miyamoto J, Kasubuchi M, Nakajima A, Irie J, Itoh H, et al.
The role of short-chain fatty acid on blood pressure regulation.
Curr Opin Nephrol Hypertens 2016;25(5): 379-383.
- Packer CS, Rice AE, Johnson TC Oxidized low density
lipoprotein (OX-LDL) induced arterial muscle contraction
signaling mechanisms. Open Hyperten J 2014;6: 20-26.
- Ma J, Li H. The Role of Gut Microbiota in Atherosclerosis
and Hypertension. Front Pharmacol. 2018;9:1082. DOI:
10.3389/fphar.2018.01082 PMID: 30319417
- Ott SJ, El Mokhtari NE, Musfeldt M, Hellmig S, Freitag S,
Rehman A, et al. Detection of diverse bacterial signatures in
atherosclerotic lesions of patients with coronary heart disease.
Circulation. 2006;113(7):929-37. DOI:
10.1161/CIRCULATIONAHA.105.579979 PMID: 16490835
- Lam V, Su J, Koprowski S, Hsu A, Tweddell JS, Rafiee P, et
al. Intestinal microbiota determine severity of myocardial
infarction in rats. FASEB J. 2012;26(4):1727-35. DOI:
10.1096/fj.11-197921 PMID: 22247331
- Lam V, Su J, Hsu A, Gross GJ, Salzman NH, Baker JE.
Intestinal Microbial Metabolites Are Linked to Severity of
Myocardial Infarction in Rats. PLoS One. 2016;11(8):e0160840.
DOI: 10.1371/journal.pone.0160840 PMID: 27505423
- Gan XT, Ettinger G, Huang CX, Burton JP, Haist JV,
Rajapurohitam V, et al. Probiotic administration attenuates
myocardial hypertrophy and heart failure after myocardial
infarction in the rat. Circ Heart Fail. 2014;7(3):491-9. DOI:
10.1161/CIRCHEARTFAILURE.113.000978 PMID: 24625365
- Patterson E., Cryan J. F., Fitzgerald G. F., Ross R. P.,
Dinan T. G., Stanton C. Gut microbiota, the pharmabiotics they
produce and host health. Proceedings of the Nutrition Society.
2014;73(4):477–489. doi: 10.1017/S0029665114001426.
- Pasini E., Aquilani R., Testa C., et al. Pathogenic gut
flora in patients with chronic heart failure. JACC: Heart
Failure. 2016;4(3):220–227. doi: 10.1016/j.jchf.2015.10.009
- Luedde M., Winkler T., Heinsen F. A., et al. Heart failure
is associated with depletion of core intestinal microbiota. ESC
Heart Failure. 2017;4(3):282–290. doi: 10.1002/ehf2.12155.
- Kamo T., Akazawa H., Suda W., et al. Dysbiosis and
compositional alterations with aging in the gut microbiota of
patients with heart failure. PLoS One. 2017;12(3):e0174099. doi:
10.1371/journal.pone.0174099.
- Kummen M., Mayerhofer C. C. K., Vestad B., et al. Gut
microbiota signature in heart failure defined from profiling of
2 independent cohorts. Journal of the American College of
Cardiology. 2018;71(10):1184–1186. doi:
10.1016/j.jacc.2017.12.057.
- Arpaia N., Campbell C., Fan X., et al. Metabolites produced
by commensal bacteria promote peripheral regulatory T-cell
generation. Nature. 2013;504(7480):451–455. doi:
10.1038/nature12726
- Kitai T, Kirsop J, Tang WH. Exploring the Microbiome in
Heart Failure. Curr Heart Fail Rep. 2016;13(2):103-9. DOI:
10.1007/s11897-016-0285-9 PMID: 26886380
- Tang WHW, Wang Z, Fan Y, Levison B, Hazen JE, Donahue LM, et
al. Prognostic Value of Elevated Levels of Intestinal
Microbe-Generated Metabolite trimethylamine-N-oxide in Patients
With Heart Failure: Refining the Gut Hypothesis. J Am Coll
Cardiol. 2014;64(18):1908-14. DOI: 10.1016/j.jacc.2014.02.617
PMID: 25444145
- Skok P, Skok K. Prebavna cev in srčno-žilne bolezni – ali
imajo kaj skupnega? Zdrav Vestn. 2020;89(9–10):528–38.
- Bäckhed F, Ding H, Wang T, Hooper LV, Koh GY, et al. The gut
microbiota as an environmental factor that regulates fat
storage. Proc Natl Acad Sci USA 2004;101(4):15718-15723.
- Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, et
al. An obesity-associated gut microbiome with increased capacity
for energy harvest. Nature 2006;444(7122): 1027-1031.
- Samuel BS, Shaito A, Motoike T, Rey FE, Backhed F, et al.
Effects of the gut microbiota on host adiposity are modulated by
the short- chain fatty-acid binding G protein-coupled receptor,
Gpr41. Proc Natl Acad Sci USA 2008;105(43): 16767-16772.
- Bäckhed F, Manchester JK, Semenkovich CF, Gordon JI Mecha
nisms underlying the resistance to diet-induced obesity in
germ-free mice. Proc Natl Acad Sci USA 2007;104(3): 979-984.
- Ley RE, Bäckhed F, Turnbaugh P, Lozupone CA, Knight RD, et
al. Obesity alters gut microbial ecology. Proc Natl Acad Sci USA
2005;102: 11070-11075.
- Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, et al.
Metabolic endotoxemia initiates obesity and insulin resistance.
Diabetes 2007;56(7):1761-1772.
- de La Serre CB, Ellis CL, Lee J, Hartman AL, Rutledge JC, et
al. Propensity to high-fat diet-induced obesity in rats is
associated with changes in the gut microbiota and gut
inflammation. Am J Physiol Gas- trointest Liver Physiol
2010;299(4): G440-G448.
- Harris K, Kassis A, Major G, Chou CJ Is the gut microbiota a
new factor contributing to obesity and its metabolic disorders?.
J Obes 2012;2012: 879151. doi: 10.1155/2012/879151.
- Jia Q, Li H, Zhou H, Zhang X, Zhang A, Xie Y, et al.
Microbiota and irritable bowel syndrome: A critical inventory.
Cardiovasc Ther. 2019;2019:5164298. DOI: 10.1155/2019/5164298
PMID: 31819762
- Salehi-Abargouei A, Maghsoudi Z, Shirani F, Azadbakht L.
Effects of Dietary Approaches to Stop Hypertension (DASH)-style
diet on fatal or nonfatal cardiovascular diseases—incidence: a
systematic review and meta-analysis on observational prospective
studies. Nutrition. 2013;29(4):611-8. DOI:
10.1016/j.nut.2012.12.018 PMID: 23466047
- Rifai L, Pisano C, Hayden J, Sulo S, Silver MA. Impact of
the DASH diet on endothelial function, exercise capacity, and
quality of life in patients with heart failure. Proc Bayl Univ
Med Cent. 2015;28(2):151-6. DOI: 10.1080/08998280.2015.11929216
PMID: 25829641
- Lopez-Garcia E, Rodriguez-Artalejo F, Li TY, Fung TT, Li S,
Willett WC, et al. The Mediterranean-style dietary pattern and
mortality among men and women with cardiovascular disease. Am J
Clin Nutr. 2014;99(1):172-80. DOI: 10.3945/ajcn.113.068106 PMID:
24172306
- De Filippis F, Pellegrini N, Vannini L, Jeffery IB, La
Storia A, Laghi L, et al. High-level adherence to a
Mediterranean diet beneficially impacts the gut microbiota and
associated metabolome. Gut. 2016;65(11):1812-21. DOI:
10.1136/gutjnl-2015-309957 PMID: 26416813
- M. Trøseid et alThe gut microbiome in coronary artery
disease and heart failure: Current knowledge and future
directions Review| 2020;52:102649. Published: February 18, 2020
DOI:https://doi.org/10.1016/j.ebiom.2020.102649
- Hill C. Guarner F. Reid G. Gibson G.R.Merenstein D.J. Pot B.
et al. Expert consensus document. the international scientific
association for probiotics and prebiotics consensus statement on
the scope and appropriate use of the term probiotic.Nat Rev
Gastroenterol Hepatol. 2014;11:506-514.
- Patel R. DuPont H.L. New approaches for bacteriotherapy:
prebiotics, new-generation probiotics, and synbiotics. Clin
Infect Dis. 2015; 60: S108-S121.
- Lam V. Su J. Koprowski S. Hsu A. Tweddell J.S. Rafiee P. et
al. Intestinal microbiota determine severity of myocardial
infarction in rats. FASEB J. 2012; 26: 1727-1735.
- Gan X.T. Ettinger G. Huang C.X. Burton J.P. Haist J.V.
Rajapurohitam V. et al. Probiotic administration attenuates
myocardial hypertrophy and heart failure after myocardial
infarction in the rat. Circ Heart Fail. 2014; 7: 491-499.
- Costanza A.C. Moscavitch S.D. Faria Neto H.C. Mesquita E.T.
Probiotic therapy with saccharomyces boulardii for heart failure
patients: a randomized, double-blind, placebo-controlled pilot
trial. Int J Cardiol. 2015; 179: 348-350.
- He Z. Wang J. Chen Y. Cong X. Li N. Ding R. et al. Potential
risk associated with direct modulation of the gut flora in
patients with heart failure. ESC Heart Fail. 2019; 6: 555-556.
- Mayerhofer C.C.K. Awoyemi A. Hov J.R. Troseid M. Broch K.
Reply: potential risk associated with direct modulation of the
gut flora in patients with heart failure.ESC Heart Fail. 2019;
6: 557-558.
- Yelin I. Flett K.B. Merakou C. Mehrotra P. Stam J. Snesrud
E. et al. Genomic and epidemiological evidence of bacterial
transmission from probiotic capsule to blood in ICU patients.
Nat Med. 2019; 25: 1728-1732.
- Gibson G.R. Hutkins R. Sanders M.E. Prescott S.L. Reimer
R.A. Salminen S.J. et al. Expert consensus document: the
international scientific association for probiotics and
prebiotics (ISAPP) consensus statement on the definition and
scope of prebiotics. Nat Rev Gastroenterol Hepatol.
2017;14:491-502.
- Chambers E.S. Preston T. Frost G. Morrison D.J. Role of gut
microbiota-generated short-chain fatty acids in metabolic and
cardiovascular health.Curr Nutr Rep. 2018; 7: 198-206.
- Johnson L.P. Walton G.E. Psichas A. Frost G.S. Gibson G.R.
Barraclough T.G. Prebiotics modulate the effects of antibiotics
on gut microbial diversity and functioning in vitro. Nutrients.
2015; 7: 4480-4497.
- Chambers E.S. Byrne C.S. Morrison D.J. Murphy K.G. Preston
T. Tedford C. et al. Dietary supplementation with
inulin-propionate ester or inulin improves insulin sensitivity
in adults with overweight and obesity with distinct effects on
the gut microbiota, plasma metabolome and systemic inflammatory
responses: a randomised cross-over trial. Gut. 2019; 68:
1430-1438.
- Lin PP, Hsieh YM, Kuo WW, Lin YM, Yeh YL, Lin CC, et al.
Probiotic-fermented purple sweet potato yogurt activates
compensatory IGFIR/PI3K/Akt survival pathways and attenuates
cardiac apoptosis in the hearts of spontaneously hypertensive
rats. Int J Mol Med. 2013;32(6):1319-28. DOI:
10.3892/ijmm.2013.1524 PMID: 24127171
- Tiihonen K, Tynkkynen S, Ouwehand A, Ahlroos T, Rautonen N.
The effect of ageing with and without non-steroidal
anti-inflammatory drugs on gastrointestinal microbiology and
immunology. Br J Nutr. 2008;100(1):130-7. DOI:
10.1017/S000711450888871X PMID: 18279548
- Zhou X, Li J, Guo J, Geng B, Ji W, Zhao Q, et al.
Gut-dependent microbial translocation induces inflammation and
cardiovascular events after ST-elevation myocardial infarction.
Microbiome. 2018;6(1):66. DOI: 10.1186/s40168-018-0441-4 PMID:
29615110
- Conraads V.M. Jorens P.G.De Clerck L.S.van Saene H.K. Ieven
M.M. et al. Selective intestinal decontamination in advanced
chronic heart failure: a pilot trial.Eur J Heart Fail. 2004; 6:
483-491.
- Fox M.APeterson S. Fabri B.M. van Saene H.K. Selective
decontamination of the digestive tract in cardiac surgical
patients. Crit Care Med. 1991; 19: 1486-1490.
- Tang T.W.H. Chen H.C. Chen C.Y. Yen C.Y.T. Lin C.J.
Prajnamitra R.P. et al. Loss of gut microbiota alters immune
system composition and cripples postinfarction cardiac repair.
Circulation. 2019; 139: 647-659.
- Lam V. Su J. Koprowski S. Hsu A. Tweddell J.S. Rafiee P. et
al.Intestinal microbiota determine severity of myocardial
infarction in rats.FASEB J. 2012; 26: 1727-1735.
- Lam V. Su J. Hsu A. Gross G.J. Salzman N.H. Baker J.E.
Intestinal microbial metabolites are linked to severity of
myocardial infarction in rats. PLoS ONE. 2016; 11:e0160840.
- Andraws R. Berger J.S. Brown D.L. Effects of antibiotic
therapy on outcomes of patients with coronary artery disease: a
meta-analysis of randomized controlled trials.JAMA. 2005; 293:
2641-2647.
- Winkel P. Hilden J. Hansen J.F. Kastrup J. Kolmos H.J.
Kjoller E.et al. Clarithromycin for stable coronary heart
disease increases all-cause and cardiovascular mortality and
cerebrovascular morbidity over 10years in the claricor
randomised, blinded clinical trial. Int J Cardiol. 2015; 182:
459-465.
- Knoop K.A.McDonald K.G. Kulkarni D.H. Newberry R.D.
Antibiotics promote inflammation through the translocation of
native commensal colonic bacteria. Gut. 2016; 65: 1100-1109.
- Colman RJ, Rubin DT Fecal microbiota transplantation as
therapy for inflammatory bowel disease: a systematic review and
meta-analysis. J Crohns Colitis 2014;8(12): 1569-1581.
- Vrieze A, Van Nood E, Holleman F, Salojärvi J, Kootte RS, et
al. Transfer of intestinal microbiota from lean donors increases
insulin sensitivity in individuals with metabolic syndrome.
Gastroenterolo- gy 2012;143(4): 913-916.
- Petrof E, Gloor G, Vanner S, Weese SJ, Carter D, et al.
Stool substitute transplant therapy for the eradication of
Clostridium difficile infection: ‘repopulating’ the gut.
Microbiome 2013;1(1): 3.
|
|
|
|

