|
|
|
|
Osetljive grupe na COVID-19 i komorbiditeti Stopa smrtnosti
je u visokoj korelaciji sa godinama starosti, sa relativno niskom
stopom za mlade i relativno visokim stopama među starijom
populacijom [1, 2, 3]. Posebno su osetljive starije osobe od 65
praćene komorbiditetima (hipertenzija, dijabetes, gojaznost,
kardivaskularni bolesnici, bubrežni bolesnici). Većina onih koji
umru od Covid-19 imaju već postojeća, osnovna stanja, uključujući
hiopertenziju, dijabetes melitus i kardiovaskularne bolesti [4].
Prema podacima iz marta iz Sjedinjenih Država, 89% hospitalizovanih
imalo je već postojeće osnovno stanje [5]. Italijanski Institut
Superiore de Sanita izvestio je da od 8,8% smrtnih slučajeva tamo
gde su bili dostupni medicinski kartoni, 96,1% ljudi imalo najmanje
jedan komorbiditet a prosek po pacijentu je bilo 3,4 bolesti [6].
Prema ovom izveštaju, najčešći komorbiditeti su hipertenzija (66%
smrtnih slučajeva), dijabetes tipa 2 (29,8% smrtnih slučajeva),
ishemijska bolest srca (27,6% smrtnih slučajeva), atrijalna
fibrilacija (23,1% smrtnih slučajeva) i hronična bubrežna
insuficijencija (20,2% umrlih). Hipertenzija je snažno povezana sa
upalom pluća u slučaju COVID-19 i jedan je od najčešćih
komorbiditeta viđenih kod pacijenata sa ozboljnom upalom pluća
[7,8,9,10,11]. Takođe, gojaznost doprinosi povećanom zdravstvenom
riziku od COVID-19 [12,13,14]. Takođe postoji i polni dimorfizam u
pogledu osetljivosti na COVID-19. Muškarci su osetljiviji. Upravo,
rani epidemiološki podaci za Kinu i Italiju su pokazali veću stopu
smrtnosti kod muškaraca [15, 16,17]. Takođe, u Evropi je 57%
zaraženih bilo muškarci, a 72% umrlih od Covid-19 bilo je muškaraca
[18].
Smanjena ekspresija ACE2 receptora kod osetljivih grupa na
COVID-19
Naime naučnici koji su analizirajući ACE2 u 30 različitih tkiva
na hiljade pacijenata ustanovili značajno smanjenje ekspresije gena
u starosnim grupamo posebno nakon 60 godina [19]. To je u skladu sa
rezultatima iz prakse gde deca i mladi uglavnom asimptomatski
podnose infekciju sa SARS-CoV2, a sa starošću se povećava
verovatnoća da se uđe u teško stanje i nastane smrtni ishod. Isti
naučnici koji su ustanovili da se tokom starenja smanjuje ekspresija
ACE2 su ustanovili da i kod osoba sa dijabetesom tip 2 postoji
značajno smanjenje ekspresije ACE2 gena [19]. Smanjenu glomerulna iu
tubularna ekspresija ACE2 receptora je ustanovljena kod pacijenata
sa tipom 2 dijabetesom i bolestima bubrega [20]. Ekspresija ACE2 je
posebno karakteristična za endotelijum bubrega i srca. ACE2
ekspresija u ovim organima je značajno niska kod modela spontano
hipertenzivnih pacova. Sledi da je kod hipertenzije smanjena
ekspresija ACE2 [21]. Pokazano je da se ekspresija ACE2 na
životinjskim modelima smanjuje starenjem i niža je kod muškaraca
nego kod žena, objašnjavajući tako fenomen da stariji muškarci imaju
veću verovatnoću da podlegnu COVID-19 povezanih plućnih komplikacija
[22,23]. Kako smo napred naveli posebno osetljive grupe sa
hipertenzijom a poznato je da hipertenzija značajno smanjuje
ekspresiju ACE2, zbog toga su pacijenti sa hipertenzijom skloniji da
imaju nivo ACE2 ispod određenog praga, što ih čini ranjivijim za
oštećenje pluća u slučaju COVID-19 [24]. Uostalom najbolji model
Smanjene ekspresije ACE2 receptora preko određenog praga (tačka
početka ARDS) je ključan proces za ozbiljnosti oštećenja pluća i
potencijalne fibroze [25] (Slika 1.).
Slika 1. Oštećenja pluća povezana sa SARS-CoV-2 na
osnovu različite ekspresije ACE2 proteina.
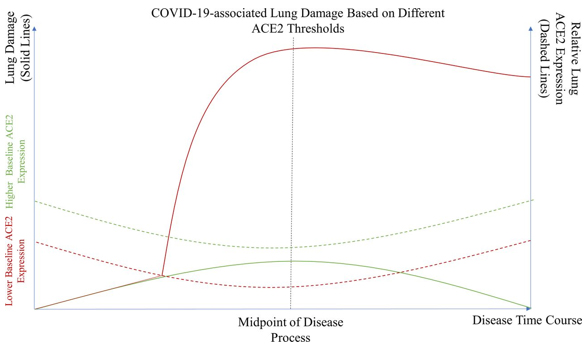
Teorijski model koji ilustruje ozbiljnost oštećenja pluća kod
pacijenta sa normalnom ili višom osnovnom ekspresijom (zelena puna
linija) naspram onih koji imaju nižu osnovnu ekspresiju ACE2
receptora zbog određenih komorbiditeta ili faktora rizika (crvena
puna linija). Pacijenti sa višom osnovnom ekspresijom ACE2 nikada ne
ispunjavaju kritični prag ekspresije ACE2 (zelena tačkasta linija) i
samim tim je manja verovatnoća da će doživeti značajna oštećenja
pluća. Međutim, veća je verovatnoća da će pacijent sa nižom osnovnom
ekspresijom ACE2 dostići prag ekspresije ACE2 (crvena tačkasta
linija) i zbog toga pretrpeće teža oštećenja pluća.
Uloga ACE2 receptora sa aspekta patološkog delovanja
SARS-CoV-2
Kada je Covid-19 u pitanju posebno su osetljivi organi u kojima
postoji velika funkcionalna površina koju treba zaštiti od agresije
imunološkog sistema. U tom smislu najbolji primer su pluća.
Bronhialna i alveolarna razgranatost. ACE2 se primarno eksprimira u
ćelijama kluba (club cells) distalnih bronhiola i pneumocitama tipa
2 u alveolarnom epitelu. Obe vrste ćelija su uključene u Acute
respiratory distress syndrome (ARDS). Ćelije kluba (club cells) luče
rastvor sličan surfaktantu i proteinima koji štite od upale disajnih
puteva (ataka imunološkog sistema) i opksidativnog stresa.
Pneumociti tipa 2 su „branilac“ alveola i sintetišu, izlučuju i
recikliraju sve komponente surfaktanta koji regulišu površinsku
napetost alveola u plućima [28]. U prilog ovome ide i činjenica da
su ACE2 receptori češće izraženi u ćelijama donjeg od gornjih
respiratornih grana [27]. Ako pogledamo i ostale osetljive organe u
slučaju COVID-19 zajednička karakteristika je velika funkcionalna
površina. Tamo gde postoje, kanali i kanalići. Tako na primer, a
jednoćelijskim RNK-sekvenciranjem pokazano je da se ACE2 prvenstveno
eksprimira u alveolarnim ćelijama tipa II pluća, ćelijama
proksimalnih tubula u bubregu, ćelijama miokrada, epitelnim ćelijama
ileuma i jednjaka i urotelijalnim ćelijama mokraćne bešike [26]. Iz
ovoga sledi zaštitna uloga ACE2 velikih površina od ataka
imunološkog sistema. U prilog tome ide Akutni respiratorni distres
sindrome (ARDS) koji je karakterističan za COVID-19. Biopsija pluća
je ukazala na značajan inflamatorni odgovor i edem, poput onog koji
se primećuje na životinjskim modelima sa smanjenom ekspresijom ACE2,
kao i onima kod životinja zaraženih SARS-om i kod biopsije pluća
ljudi zaraženih SARS-om [29,30]. Ovaj nalaz takođe korelira sa onima
iz primeraka uzorka pluća zaraženih H5N1, pokazajući značajno
oštećenje pluća usled prekomerne inflamatorne reakcije prekomernim
oslobađanjem citokina [31].
Molekularna funkcija ACE2 receptora na ćelijskom nivou
ACE2 (angitenzin konvertujući enzim 2) pripada porodici
angiotenzin konvertujućih enzima dipeptidil karboksidipeptidaza.
Između ostalih funkcija katalizuje cepanje angiotenzina I u
angiotenzin 1-9, a angiotenzin II u vazodilatatorni angiotenzin 1-7.
Značajan za renin-angiotenzin hormonski sistem koji je kritičan
regulator blood volume, systemic vascular resistance, and thus
cardiovascular homeostasis [32, 33]. Osim ovoga ACE2 uklanja C
terminalne ostatke drugih vazoaktivnih peptida: neurotensin,
kinetensin i des-Arg bradykinin [34,35]. Takođe cleaves (cepa) i
druge biološki aktivne peptide kao što su: apelini, casomorphins i
dynorphin A [35,36]. Važan je i za transport neutralnih
aminikiselina u epitelnim ćelijama creva [37].
Ekspresija ACE2 receptora je posebno karakteristična za:
-alveolarne ćelije tip 2 [38,39,40],
-endotelne ćelije malih i velikih arterija, kao i glatke mišićne
ćelije arterija [41],
- enterocite tankog creva, Lejdigove i Sertolijeve ćelije [41],
-proksimalne tubule bubrega i tanko crevo [37],
-srce, bubreg, testis i gastrintestinalni sistem
[34,42,43,44,45,46].
Zajednička karakteristika svih ovih ćelija, tkiva i organa sa
izraženom ekspresijom ACE2 je značajna funkcionalna površinu.
Postoje ogromne ćelijske, tkivne površine koje su bitne za
realizaciju funkcije. Sa ovog aspekta jasno je da ACE2 ima značajnu
ulogu u održavanju stabilnosti velikih funkcionalnih površina. U tom
smislu njegova uloga u produkciji surfaktanta izuzetno značajna u
realizaciji napred navedene funkcije. U tom pogledu posebno se
ističu pluća sa njihovim velikim funkcionalnim površinama. Tako na
primer U plućima ACE2 receptor se nalazi na vrhu plućnih ćelija
poznatih kao ćelije alveolarnog epitela tipa 2 (AE2). Ove ćelije
imaju važnu ulogu u stvaranju surfaktanta. Veruje se da plućni
surfaktant reguliše površinski napon alveola u plućima sisara. Prema
našim saznanjima, veruje se da ćelije ACE2 deluju kao
imunoregulatorne ćelije [47]. Vezu između akutne povrede pluća
praćeno inflamacijom, produkcije surfaktanta i ACE2 receptora
odslikava eksperimentalni rad pacovima. Smanjena aktivnost ACE2 je
direktno povezana sa smanjenom produkcijom surfaktanta [48]. O
značaju surfaktanta proizvedenog u alveolarnim ćelijama pluća ulozi
ACE2 i upalnih procesa pluća, kao i upotrebi sintetičkih i prirodnih
surfaktanata u slučaju COVID-19 govore i autori [49].
Intenzivnim vezivanjem za ACE2 virus SARS-CoV-2 inhibira
produkciju surfaktanata
Kao što je više puta ponovljeno virus SARS-CoV-2 koji je u osnovi
pandemije COVID-19 se razlikuje od ostalih SARS virusa po tome što
je usled novonastale mutacije u delu S proteina stekao sposobnost
intenzivnijeg vezivanja za ACE2 receptor kao ulazna vrata za
infekciju ćelije. Iz toga sledi da je on novonastalom promenom
stekao uslov patogenosti a realizacije svoju patogenost intenzivnim
vezivanjem i inaktivacijom ACE2 receptora. Potvrda ovoga je
nefunkcionisanje ACE2 receptora usled mutacije ACE2 gena. Kod osoba
sa mutiranim i nefunkcionalnim ACE2 genom nastaje Severe acute
respiratory syndrome (SARS) kao i sve ono što je tipično i prati
COVID-19 [50,56]. Osim Severe acute respiratory syndrome (SARS)
tipično za COVID-19 nefunkcionisanje ACE2 receptora povezano je i
sa: hipertenzijom, bolestima bubrega, miokardijalnoj infrakciji,
dijabetes melitus, bolestima krvnih sudova [56]. Svuda tamo gde su
velike funkcionalne površine, gde su u pitanju kanali. A povrh svega
ovo su sve komorbiditeti koji su u vezi sa COVID-19. Iz tog razloga
u budućnosti poželjno je izučavati ulogu ACE2 receptora sa aspekte
produkcije surfaktanata na hronična oboljenja ovog tipa. SARS-CoV-2
intenzivnim vezivanjem za ACE2 može suzbiti proizvodnju surfaktanta
u ćelijama ćelije alveolarnog epitela tipa 2 (AE2) [47]. Da je
klinička slika upalnih procesa na nivou pluća SARS and ARDS
posledica smanjene produkcije surfaktanta je takođe mutacija,
odnosno nefunkcionisanje gena odgovornih za produkciju pojedinih
komponenti surfaktanta SFTPA, SFTPB, SFTBC, SFTBD, SFTA2, SFTA3.
Posledica je ista kao i u slučaju inhibiocije ACE2 receptora
intenzivnim vezivanjem SARS-CoV-2 virusa. Nastaje Respiratory
Distress Syndrome in Premature Infants Pulmonary Fibrosis,
Interstitial Pneumonia [51,52,53,54,55]. Iz svega napred sledi da
nefunkcinisanje ACE2 receptora, bilo intenzivnim vezivanjem
SARS-CoV-2 ili njegovom mutacijom, kao i nefunkcionisanje odgovornih
gena za sintezu pojedinih komponenti surfaktanta ima istu posledicu
kada su u pitanju oštećenja na nivou pluća a nije isključeno i na
nivou drugih organa SARS odnosno ARDS. Odavde sledi da molekularno
mesto realizacije patološkog efekta virusa SARS-CoV-2 je vezana za
održavanje stabilnosti površinski aktivnih komponenti, odnosno
konretno u ovom slučaju za inhibiciju produkcije surfaktanata.
Uloga surfaktanta u stabilizaciji velikih funkcionalnih
površina i imunoprotektivna uloga
Kada su u pitanju velike funkcionalne površine surfaktanti imaju
dvostruku ulogu: smanjenje površinskog napona i imunoprotektivnu
ulogu. To su dve oprečne funkcije. Surfaktant sa svojim
fizičko-hemijskim karakteristikama treba da istovremeno obezbedi
biohemijsku funkcionalnost velikih površina ali istovremeno da štiti
velike površine i njihove antigenske specifičnosti od sistemskog
imuniteta. Iz tog razloga je hemijski sastav surfaktanta izuzetno
značajan ali i izuzetno ranjiv. Svaka promena sastava i strukture
ima sistemski značaj. Posebno za organe gde se funkcija realizuje na
bazi velikih funkcionalnih površina. Kao što su mali krvni sudovi,
grane i alveole pluća, nefronske cevčice bubrega, gastrointestinalni
trakt, pa i krvne pločice. Jedan od značajnih dokaza molekularnog
mehanizma patogenog delovanja virusa SARS-CoV-2 posredstvom blokade
ACE2 receptora i inhibicije produkcije surfaktanta su osetljive
grupe u slučaju COVID-19. U prvom redu osobe sa hipertenzijom,
kardiovaskularni bolesnici, osobe sa opstruktivnim plućima, bubrežni
bolesnici, starije osobe (smanjena elastičnost, krvnih sudova i
disajnih puteva. U svim ovim slučajevima u osnovi komorbiditeta je
funkcionalnos velikih funkcionalnih površina. Surfaktan je bitan na
svim velikim funkcionalnim površinama, ali su u tom smilsu su
posebno ranjiva pluća [57,58]. Jer za razmenu gasova je neophodna
ogroman funkcionalna površina, funkcionalna površina koja će
obezbediditi interakciju dve sredine gasovite i tečne [59,60] ali
istovremeno ta površina nesme biti iritabilna za sistemski imunitet
[61,62]. Jer nikako nesme da se naprave lokalni inflamatorni procesi
koji će iritirati veliki sistemski imunitet na reakciju. Kada do
dtoga dođe onda je to odgovor sistemskog imuniteta na otvorene
površinske antigene pluća izuzetno buran. Nastaje SARS odnosno
ADARS.
Molekularni mehanizam patološkog delovanja virusa SARS-CoV-2
sa aspekta vezivanja za ACE2 receptor i inhicije produkcije
surfaktanta
Nakon infekcije SARS-CoV-2 počinje trka sa vremenom: sa jedne
strane umnožavanje virusa, a sa druge strane reakcija imunog sistema
na prisustvo virusa. To je trka sa vremenom u produkciji i
inhibiciji produkcije surfaktanta. O čemu se radi?
Umnožavanje virusa se realizuje preko ACE2 receptora to su njegova
ulazna vrata. Ali sa umnožavanjem virusa sve je više virusa koji se
vezuju za ACE2 receptore čime se inhibira aktivnost ACE2 receptora i
smanjuje produkcija surfaktanta. Ako osoba ima veći broj aktivnih
receptora potrebno je duže vreme da se virus umnoži i blokira
kritičnu masu ACE2 receptora. To produženo vreme koristi imuni
sistem i razvija se imunitet na SARS-CoV-2. Zato su osobe sa
povećanom ekspresijom ACE2 otpornije otpornije na SARS-CoV-2. U ovim
slučajevima se produžava neophodno vreme za reakciju imunog sistema
i zato ove osobe ili imaju asimptomtaske slučajeve ili imaju blažu
reakciju. To je zelena puna linija kod predloženog modela (Slika 1.)
Suprotno ovome, kod osoba sa smanjenom ekspresijom ACE2 receptora,
starije osobe, komorbiditeti, gojazne osobe, nakon umnožavanja
virusa u jednom trenutku se blokira kritična masa ACE2 receptora i
smanjuje se produkcija surfaktanta do te mere da pojedine ogromne
funkcionalne površine postaju antigenski ogoljene, otvorene i
iritabilne za sistemski imunološki sistem i nastaje ARDS ili SARS.
To je prag o kome se govori u predloženom modelu (Slika 1). Kako su
pluća u pogledu ogromne funkcionlane površine i značajnosti
surfaktanta posebno osetljiva u tom pogledu, kada se ovaj prag pređe
nastaje ARDS. Tada kreće borba za život i to je zapravo borba sa
aktiviranim imunim sistemom vlastitog organizma. To je zapravo
autoimuni odgovor organizma. Između ostalog zato su lekovi za
supresiju imunološkog sistema koji se inače koriste za lečenje
pojedinih autoimunih oboljenja pokazali dobre rezultate. U svakom
slučaju, neophodna su dalja istraživanja u ovom pravcu kako bi se u
potpunosti razjasnili molekularni mehanizmi patološkog delovanja
virusa SARS-CoV-2.
REFERENCE:
- Poyiadji N, Shahin G, Noujaim D, Stone M, Patel S, Griffith
B. "COVID-19-associated Acute Hemorrhagic Necrotizing
Encephalopathy: Imaging Features". Radiology. 2020; 296 (2):
E119–E120. doi:10.1148/radiol.2020201187. PMC 7233386. PMID
32228363.
- "Living with Covid19". NIH Themed Review. National Institute
for Health Research. 15 October 2020.
doi:10.3310/themedreview_41169.
- "How long does COVID-19 last?". UK COVID Symptom Study. 6
June 2020. Retrieved 15 October 2020. Available from:
https://covid.joinzoe.com/post/covid-long-term
- "The Epidemiological Characteristics of an Outbreak of 2019
Novel Coronavirus Diseases (COVID-19)". China CDC Weekly.
2020;2(8):113–122. doi:10.46234/ccdcw2020.032. ISSN 2096-7071.
Retrieved 15 June 2020.
- Hu Y, Sun J, Dai Z, Deng H, Li X, Huang Q, et al.
"Prevalence and severity of corona virus disease 2019
(COVID-19): A systematic review and meta-analysis". Journal of
Clinical Virology. 2020;127: 104371.
doi:10.1016/j.jcv.2020.104371. PMC 7195434. PMID 32315817.
- Wang Y, Wang Y, Chen Y, Qin Q. "Unique epidemiological and
clinical features of the emerging 2019 novel coronavirus
pneumonia (COVID-19) implicate special control measures".
Journal of Medical Virology. 2020;92(6):568-576.
doi:10.1002/jmv.25748. PMC 7228347. PMID 32134116.
- Wu C, Chen X, Cai Y, et al. Risk factors associated with
acute respiratory distress syndrome and death in patients with
coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern
Med 2020;180(7):934-943. doi: 10.1001/jamainternmed.2020.0994.
- Yang J, Zheng Y, Gou X, et al. Prevalence of comorbidities
in the novel Wuhan coronavirus (COVID-19) infection: a
systematic review and meta-analysis. Int J Infect Dis.
2020;94:91-95. doi: 10.1016/j.ijid.2020.03.017.
- Zhang J-J, Dong X, Cao Y-Y, et al. Clinical characteristics
of 140 patients infected with SARS-CoV-2 in Wuhan, China.
Allergy 2020;75:1730–41.
- Peng YD, Meng K, Guan HQ, et al. [Clinical characteristics
and outcomes of 112 cardiovascular disease patients infected by
2019- nCoV]. Zhonghua Xin Xue Guan Bing Za Zhi 2020;48:E004.
- Emami A, Javanmardi F, Pirbonyeh N, et al. Prevalence of
underlying diseases in hospitalized patients with COVID-19: a
systematic review and meta-analysis. Arch Acad Emerg Med
2020;8:e35.
- Henry BM. "COVID-19, ECMO, and lymphopenia: a word of
caution". The Lancet Respiratory Medicine Elsevier.
2020;8(4):e24. doi:10.1016/s2213-2600(20)30119-3. PMC 7118650.
PMID 32178774.
- "COVID-19 Treatment Guidelines". Available from:
https://www.covid19treatmentguidelines.nih.gov/. National
Institutes of Health. Retrieved 18 January 2021./
- Hsu, Jeremy. "Covid-19: What now for remdesivir?". BMJ.
2020;371:m4457. doi:10.1136/bmj.m4457. ISSN 1756-1833. PMID
33214186.
- Alwan NA, Burgess RA, Ashworth S, Beale R, Bhadelia N,
Bogaert D, et al. "Scientific consensus on the COVID-19
pandemic: we need to act now". Lancet. 2020;396(10260):e71–e72.
doi:10.1016/S0140-6736(20)32153-X. PMC 7557300. PMID 33069277.
- Meyerowitz-Katz G, Merone L. "A systematic review and
meta-analysis of published research data on COVID-19 infection
fatality rates". International Journal of Infectious Diseases.
2020;101: 138–148. doi:10.1016/j.ijid.2020.09.1464. PMC 7524446.
PMID 33007452.
- Zhang D, Hu M, Ji Q. "Financial markets under the global
pandemic of COVID-19". Finance Research Letters. 2020;36:101528.
Bibcode:2020CSFX....500043D. doi:10.1016/j.csfx.2020.100043. PMC
7402242. PMID 32837360.
- "Global Research and Innovation Forum on COVID-19: Virtual
Press Conference" . World Health Organization. Available from:
https://www.who.int/docs/default-source/coronaviruse/virtual-press-conference---2-july---update-on-covid-19-r-d.pdf
- Chen J, Jiang Q, Xia X, et al. Individual Variation of the
SARS-CoV-2 Receptor ACE2 Gene Expression and Regulation. Aging
Cell 2020;19(7):e13168.. doi: 10.1111/acel.13168.
- Heather N. Reich, Gavin Y. Oudit, Josef M. Penninger, James
W. Scholey and Andrew M. Herzenberg Decreased glomerular and
tubular expression of ACE2 in patients with type 2 diabetes and
kidney disease. 2008;74(12):1610-6. doi: 10.1038/ki.2008.497.
- Gavin Y.Oudit Michael A.Crackower Peter H.Backx Josef
M.Penninger The Role of ACE2 in Cardiovascular Physiology Trends
in Cardiovascular Medicine 2003;13(3):93-101.
https://doi.org/10.1016/S1050-1738(02)00233-5
- Oelkers WK. Effects of estrogens and progestogens on the
reninaldosterone system and blood pressure. Steroids
1996;61:166–71.
- Sampson AK, Moritz KM, Denton KM. Postnatal ontogeny of
angiotensin receptors and ACE2 in male and female rats. Gend Med
2012;9:21–32.
- Crackower MA, Sarao R, Oudit GY, et al.
Angiotensin-converting enzyme 2 is an essential regulator of
heart function. Nature 2002;417:822–8.
- Chaudhry F, Lavandero S, Xie X, et al. Manipulation of ACE2
expression in COVID-19. Open Heart 2020;7:e001424. doi:10.1136/
openhrt-2020-001424
- Zou X, Chen K, Zou J, et al. Single-Cell RNA-seq data
analysis on the receptor ACE2 expression reveals the potential
risk of different human organs vulnerable to 2019-nCoV
infection. Front Med 2020;14:185–92.
- Wölfel R, Corman VM, Guggemos W, et al. Virological
assessment of hospitalized patients with COVID-2019. Nature
2020;581:465–9.
- Bombardini T, Picano E. Angiotensin-Converting Enzyme 2 as
the Molecular Bridge Between Epidemiologic and Clinical Features
of COVID-19. Can J Cardiol. 2020;36(5):784.e1-784.e2. doi:
10.1016/j.cjca.2020.03.026. Epub 2020 Mar 29. PMID: 32299780;
PMCID: PMC7118531.
- Kuba K, Imai Y, Rao S, et al. A crucial role of angiotensin
converting enzyme 2 (ACE2) in SARS coronavirus-induced lung
injury. Nat Med 2005;11:875–9.
- Hsiao CH, Wu M-Z, Chen C-L, et al. Evolution of pulmonary
pathology in severe acute respiratory syndrome. J Formos Med
Assoc 2005;104:75–81.
- Gu J, Xie Z, Gao Z, et al. H5N1 infection of the respiratory
tract and beyond: a molecular pathology study. Lancet
2007;370:1137–45.
- Wang W, McKinnie SM, Farhan M, Paul M, McDonald T, et al.
Angiotensin-Converting Enzyme 2 Metabolizes and Partially
Inactivates Pyr-Apelin-13 and Apelin-17: Physiological Effects
in the Cardiovascular System. Hypertension. 2016;68(2):365-77.
doi: 10.1161/HYPERTENSIONAHA.115.06892. Epub 2016 May 23. PMID:
27217402.
- Zisman LS, Keller RS, Weaver B, Lin Q, Speth R, et al.
Increased angiotensin-(1-7)-forming activity in failing human
heart ventricles: evidence for upregulation of the
angiotensin-converting enzyme Homologue ACE2. Circulation.
2003;108(14):1707-12. doi: 10.1161/01.CIR.0000094734.67990.99.
Epub 2003 Sep 22. PMID: 14504186.
- Donoghue M, Hsieh F, Baronas E, Godbout K, Gosselin M, et
al. A novel angiotensin-converting enzyme-related
carboxypeptidase (ACE2) converts angiotensin I to angiotensin
1-9. Circ Res. 2000;87(5):E1-9. doi: 10.1161/01.res.87.5.e1.
PMID: 10969042.
- Vickers C, Hales P, Kaushik V, Dick L, Gavin J, et al.
Hydrolysis of biological peptides by human
angiotensin-converting enzyme-related carboxypeptidase. J Biol
Chem. 2002;277(17):14838-43. doi: 10.1074/jbc.M200581200. Epub
2002 Jan 28. PMID: 11815627.
- Wang W, McKinnie SM, Farhan M, Paul M, McDonald T, et al.
Angiotensin-Converting Enzyme 2 Metabolizes and Partially
Inactivates Pyr-Apelin-13 and Apelin-17: Physiological Effects
in the Cardiovascular System. Hypertension. 2016;68(2):365-77.
doi: 10.1161/HYPERTENSIONAHA.115.06892. Epub 2016 May 23. PMID:
27217402.
- Kowalczuk S, Bröer A, Tietze N, Vanslambrouck JM, Rasko JE,
Bröer S. A protein complex in the brush-border membrane explains
a Hartnup disorder allele. FASEB J. 2008;22(8):2880-7. doi:
10.1096/fj.08-107300. Epub 2008 Apr 18. PMID: 18424768.
- Blume C, Jackson CL, Spalluto CM, Legebeke J, Nazlamova L,
et al. A novel ACE2 isoform is expressed in human respiratory
epithelia and is upregulated in response to interferons and RNA
respiratory virus infection. Nat Genet. 2021;53(2):205-214. doi:
10.1038/s41588-020-00759-x. Epub 2021 Jan 11. PMID: 33432184.
- Zou X, Chen K, Zou J, Han P, Hao J, Han Z. Single-cell
RNA-seq data analysis on the receptor ACE2 expression reveals
the potential risk of different human organs vulnerable to
2019-nCoV infection. Front Med. 2020;14(2):185-192. doi:
10.1007/s11684-020-0754-0. Epub 2020 Mar 12. PMID: 32170560;
PMCID: PMC7088738.
- Hikmet F, Méar L, Edvinsson Å, Micke P, Uhlén M, Lindskog C.
The protein expression profile of ACE2 in human tissues. Mol
Syst Biol. 2020;16(7):e9610. doi: 10.15252/msb.20209610. PMID:
32715618; PMCID: PMC7383091.
- Hamming I, Timens W, Bulthuis ML, Lely AT, Navis G, van Goor
H. Tissue distribution of ACE2 protein, the functional receptor
for SARS coronavirus. A first step in understanding SARS
pathogenesis. J Pathol. 2004;203(2):631-7. doi:
10.1002/path.1570. PMID: 15141377; PMCID: PMC7167720.
- Tipnis SR, Hooper NM, Hyde R, Karran E, Christie G, Turner
AJ. A human homolog of angiotensin-converting enzyme. Cloning
and functional expression as a captopril-insensitive
carboxypeptidase. J Biol Chem. 2000;275(43):33238-43. doi:
10.1074/jbc.M002615200. PMID: 10924499.
- Douglas GC, O'Bryan MK, Hedger MP, Lee DK, Yarski MA, Smith
AI, Lew RA. The novel angiotensin-converting enzyme (ACE)
homolog, ACE2, is selectively expressed by adult Leydig cells of
the testis. Endocrinology. 2004;145(10):4703-11. doi:
10.1210/en.2004-0443. Epub 2004 Jul 1. PMID: 15231706.
- Harmer D, Gilbert M, Borman R, Clark KL. Quantitative mRNA
expression profiling of ACE 2, a novel homologue of angiotensin
converting enzyme. FEBS Lett. 2002;532(1-2):107-10. doi:
10.1016/s0014-5793(02)03640-2. PMID: 12459472.
- Burrell LM, Risvanis J, Kubota E, Dean RG, MacDonald PS et
al. Myocardial infarction increases ACE2 expression in rat and
humans. Eur Heart J. 2005;26(4):369-75; discussion 322-4. doi:
10.1093/eurheartj/ehi114. Epub 2005 Jan 25. PMID: 15671045.
- Hikmet F, Méar L, Edvinsson Å, Micke P, Uhlén M, Lindskog C.
The protein expression profile of ACE2 in human tissues. Mol
Syst Biol. 2020;16(7):e9610. doi: 10.15252/msb.20209610. PMID:
32715618; PMCID: PMC7383091.
- Takano H. Pulmonary surfactant itself must be a strong
defender against SARS-CoV-2. Med Hypotheses. 2020;144:110020.
doi: 10.1016/j.mehy.2020.110020. Epub 2020 Jun 20.
- Fandiño J, Toba L, Gonzalez-Nuñez M, Diz-Chaves Y,
Gonzalez-Matías L. & Mallo F, Liraglutide increases surfactant
proteins (SPA & SPB) and angiotensin-converting enzymes (ACE &
ACE2) expression in a rat model of acute lung injury by
bleomycin. Endocrine Abstracts 2016;41:GP99. DOI:
10.1530/endoabs.41.GP99.
- Mirastschijski U, Dembinski R and Maedler K. Lung Surfactant
for Pulmonary Barrier Restoration in Patients With COVID-19
Pneumonia. Front. Med. 2020;7:254. doi: 10.3389/fmed.2020.00254
- Severe acute respiratory syndrome (SARS). Available from:
https://www.malacards.org/card/severe_acute_respiratory_syndrome
- Respiratory Distress Syndrome in Premature Infants.
Available from:
https://www.malacards.org/card/respiratory_distress_syndrome_in_premature_infants
- Surfactant Metabolism Dysfunction, Pulmonary, 2. (SMDP2)
Available from:
https://www.malacards.org/card/surfactant_metabolism_dysfunction_pulmonary_2
- Pulmonary Fibrosis, Idiopathic. Available from:
https://www.malacards.org/card/pulmonary_fibrosis_idiopathic
- Idiopathic Interstitial Pneumonia. Available from:
https://www.malacards.org/card/idiopathic_interstitial_pneumonia
- Neonatal respiratory distress. Available from:
https://www.ncbi.nlm.nih.gov/clinvar
- ACE2 MalaCards. Available from:
https://www.malacards.org/search/results?query=ACE2
- Wright JR "Host Defense Functions of Pulmonary Surfactant".
Biology of the Neonate. 2004;85(4):326-32.
doi:10.1159/000078172. PMID 15211087. S2CID 25469141.
- Nkadi PO, Merritt, TA, Pillers De-Ann M. "An overview of
pulmonary surfactant in the neonate: Genetics, metabolism, and
the role of surfactant in health and disease". Molecular
Genetics and Metabolism. 2009;97(2):95–101.
doi:10.1016/j.ymgme.2009.01.015. ISSN 1096-7192. PMC 2880575.
PMID 19299177.
- Schurch S.; Lee M, Gehr P, Qanbar R, Schürch, S. "Pulmonary
surfactant: Surface properties and function of alveolar and
airway surfactant". Pure and Applied Chemistry. 1992; 64 (11):
209–20. doi:10.1351/pac199264111745. S2CID 97007574.
- Veldhuizen R, Nag K, Orgeig S, Possmayer F. "The role of
lipids in pulmonary surfactant". Biochimica et Biophysica Acta
(BBA) - Molecular Basis of Disease. 1998; 1408 (2–3): 90–108.
doi:10.1016/S0925-4439(98)00061-1. PMID 9813256.
- Wright , JR. "Host Defense Functions of Pulmonary
Surfactant". Biology of the Neonate. 2004; 85 (4): 326–32.
doi:10.1159/000078172. PMID 15211087. S2CID 25469141.
- Nkadi PO, Merritt TA, Pillers De-Ann M. "An overview of
pulmonary surfactant in the neonate: Genetics, metabolism, and
the role of surfactant in health and disease". Molecular
Genetics and Metabolism. 2009;97(2):95–101.
doi:10.1016/j.ymgme.2009.01.015. ISSN 1096-7192. PMC 2880575.
PMID 19299177
|
|
|
|

