|
|
|
|
UVOD
Subklinički hipotiroidizam (SKH) je često kliničko stanje za koje
postoje mnoge kontroverze. Sve do danas ne postoji definitivni
konsenzus među tiroidolozima u pogledu nekoliko aspekata. Najpre,
postavlja se pitanje da li je potrebno raditi skrining na SKH, tj.
aktivno tragati za poremećajem u široj asimtomatskoj populaciji na
rutinskim periodičnim/preventivnim pregledima, ili nalaziti
slučajeve prema kliničkim indikacijama. Drugi aspekt problema je
kako procenjivati značaj ovog kliničkog stanja, kao i moguće
neželjene posledice na kardiovaskularni sistem, metaboličke
parametre i mentalno zdravlje individualnog pacijenta. Iz prva dva
pitanja proizlazi i treće, a to je: kakav terapijski pristup imati
kod SKH – lečiti, ili ne?
ŠTA JE SUBKLINIČKI HIPOTIROIDIZAM
Subklinički hipotiroidizam je poremećaj štitaste žlezde u kom je
normalan nivo tiroidnih hormona (TH), tiroksina (T4) i
trijodotironina (T3) u krvi, ali je povišen nivo tirotropina (TSH),
hipofiznog hormona, koji negativnom povratnom spregom reguliše rad
štitaste žlezde. To je biohemijska dijagnoza jer su pacijenti
tipično asimptomatski i bez znakova bolesti, te je otkrivanje SKH
obično slučajno. Tokom vremena SKH može napredovati ka kliničkom
hipotiroidizmu (KH). [1,2] SKH, u zavisnosti od dužine trajanja i
stepena povišenja TSH, može biti udružen sa povećanim rizikom od
kardiovaskularnih (KV) bolestii KV mortaliteta, negativnim uticajem
na metaboličke parametre, kognitivnom disfunkcijom, anksioznošću i
depresijom [2,3]. Predloženo je nekoliko alternativnih naziva koji
opisuju stanje SKH kao što su: kompenzovani hipotiroidizam,
preklinički hipotiroidizam, blagi hipotiroidizam, snižena tiroidna
rezerva, blaga tiroidna slabost [4].
KOLIKA JE PREVALENCA SUBKLINIČKOG HIPOTIROIDIZMA?
Procenjena ukupna prevalenca SKH u opštoj populaciji je od 4-10%
u zavisnosti od karakteristika ispitivane populacije tj. pola,
životne dobi, rase, geografskog područja, jodnog statusa [4]. SKH je
češći kod žena i kod starijih osoba. Kod žena je prevalenca od
8-10%, a kod žena starijih od 60 godina objavljena je prevalenca čak
do 20% [5,6]. Prevalenca je oko tri puta veća kod belaca nego kod
crnaca [7]. Takođe, tokom povećanja unosa joda kod prethodno
jod-deficitne populacije, može doći do lakog porasta prevalence SKH
i tiroidne autoimunosti [8]. Postoje istraživanja u kojima je nađena
skoro dva i po puta veća prevalenca SKH kod osoba sa metaboličkim
sindromom (MetS) [9]. Osim toga, SKH je češći kod pacijenta sa
Diabetes Melitus-om tip 2 (DM T2), nego kod zdrave populacije i
iznosi oko 10%, prema nekim izveštajima [10]. SKH je relativno često
stanje kod pacijenta sa hroničnom bubrežnom slabošću (HBI) i može se
naći kod oko 18% pacijenta sa HBI koji nisu na dijalizi [11].
Objavljena incidenca SKH kod trudnica je 2-2.5%, a u nekim zemljama
kao što je Kina, Belgija i severni deo Španija čak 4-13.7%. Kod dece
je prevalenca manja od 2% [12].
Naravno, da bi se procenila prevalenca ovog stanja u
populaciji/populacijama, neophodno je tačno registrovanje i
adekvatna zdravstvena statistika. Procenjene prevalence se neretko
baziraju na metaanalizama objavljenih članaka u dostupnim bazama
stručnih i naučnih radova, u kojima se analiziraju podaci iz
ograničenih uzoraka ispitanika. Na razlike u procenjenoj prevalenci
mogu uticati i različiti dijagnostički kriterijumi za ovo stanje,
npr. korišćenje ili nekorišćenje specifičnih referentnih opsega
serumskog nivoa TSH (u ovom slučaju gornje granice referentnog
opsega za pojedine populacione grupe). Istraživanja pokazuju da je
neophodno odrediti distribuciju koncentracije i opseg normalnih
vrednosti TSH, verovatno uslovljenim genetičkim faktorima, prema
životnoj dobi i rasi, odnosno drugim specifičnim karakteristikama
populacije koji bi se koristili za procenu prisustva tiroidne
disfunkcije (TD) [13]. U vezi s ovim, neki autori smatraju da je
prevalenca SKH kod starijih precenjena, pošto gornja granica
referentnog opsega za TSH raste sa godinama starosti [14].
UZROCI SUBKLINIČKOG HIPOTIROIDIZMA
Najčešći uzrok subkliničkog hipotiroidizma, kao i kliničkog, u
područjima sa dovoljnim unosom joda je hronični autoimuni
tiroiditis: Hashimoto tiroiditis (HT), atrofični tiroiditis (AT),
postpartalni tiroiditis (PPT) [3]. Autoimune tiroidne bolesti
(AITB), u koje spadaju HT, AT i PPT, su 5 do 10 puta češće kod žena,
nego kod muškaraca, prevalenca raste s godinama starosti, češće su
kod osoba koje imaju i druge autoimune bolesti, kao i kod njihovih
krvnih srodnika [3,15-17].
AITB se karakteriše patološkom infiltracijom štitaste žlezde
senzibilisanim T limfocitima i prisustvom tiroidnih autoantitela u
krvi – antimikrozomskih antitela/antitela na tiroidnu peroksidazu
(TPOAb), antitiroglobuliskih antitela (TgAb) i antitela na TSH
receptor (TRAb) [3,18,19]. Određivanje ovih antitela u serumu je
jedna od ključnih dijagnostičkih metoda za dijagnozu AITB.
S druge strane, veoma čest uzrok SKH je nedostatak joda u ishrani
jer je u svetskim razmerama još uvek izražen problem područja sa
deficitom joda [20]. Jod je mikroelement neophodan za stvaranje
tiroidnih hormona (TH), tirokisna (T4) i trijodotironina (T3) koji
se mora uneti u organizam hranom, najmanje 150 µg dnevno.
Uzroci SKH mogu biti i jatrogeni, na primer stanje nakon radiojodne,
ili operativne terapije benignih i malignih oboljenja štitaste
žlezde tj. difuzne toksične strume, toksičnog adenoma, polinodozne
toksične strume, benignih i malignih atoksičnih nodoznih struma.
Takođe, do oštećenja tkiva štitaste žlezde može dovesti radijaciona
terapija vrata zbog netiroidnih bolesti glave i vrata, uključujući i
limfom.
Jatrogeni SKH može biti i farmakološki, uzrokovan primenom lekova za
netiroidne bolesti, ili dijagnostiku, kao što su antiaritmik bogat
jodom, Amiodaron, potom Litijum, koji se koristi u psihijatriji,
kontrastna jodna stredstva, interferon-alfa i drugi citokini,
inhibitori tirozin kinaze (TKI), antituberkulotik paraaminosalicilna
kiselina (PAS), ređe aminoglutetimid. Oni dovode do SKH različitim
mehanizmima npr. tiroidnom citotoksičnošću, blokadom stvaranja i
oslobađanja TH viškom joda, smanjujući prokrvljenost tiroidnog
tkiva, delovanjem na dejodinaze tipa 2 i 3, koje učestvuju u
stvaranju TH i njihovih metabolita i drugo [21-26]. Naravno da i
antitiroidni lekovi koji se daju u terapiji hipertiroidizma, tj.
metimazol i propil tirouracil, mogu da dovedu do SKH.
Infiltracione bolesti, kao što su amiloidoza, sarkoidoza,
hemohromatoza, skleroderma, cistinoza, Ridlov tiroiditis, takođe
mogu zahvatiti štitastu žlezdu i biti uzrok snižene funkcijske
rezerve, tj. SKH [27, 28].
Kao što je već pomenuto, SKH kao posledica AITB, može često biti
udržen sa drugim autoimunim bolestima, nrp. DM tip 1, Adisonova
bolest, reumatodni artritis [29-31], ali i hromozomskim poremećajima
kao što su Daunov, ili Tarnerov sindrom [32,33], što nalaže obavezno
ispitivanje tiroidne funkcije kod pacijenata sa ovim bolestima i
sindromima.
Konsumptivni, ili „potrošni“ SKH je retko stanje koji se dešava kod
pacijenata sa hemangiomima i drugim tumorima u kojima je
eksprimirana dejodinaza tip 3, što izaziva ubrzanu razgradnju T4 i
T3 [34].
Na kraju, prolazni SKH se može naći kod pacijenata u fazi oporavka
od neautoimunih tiroiditisa, subakutnog i bezbolnog tiroiditisa, kao
i tokom oporavka od težih netiroidnih bolesti (NTB) [35].
TOK SUBKLINIČKOG HIPOTIROIDIZMA
Kod većine pacijenata SKH ostaje stabilan tokom vremena. U
zavisnosti od stepena povišenja početnog nivoa TSH, godišnje 5-8%
pacijenata sa SKH ima progresiju ka kliničkom hipotiroidizmu (KH)
[36]. S druge strane, funkcija štitaste žlezde može se tokom vremena
normalizovati kod 6-35% pacijenata, takođe u zavisnosti od početnog
nivoa TSH, kao i nivoa tiroidnih autoantitela [37]. Kod pacijenata
sa povišenim TPOAb, progresija SKH ka KH je 4.3% godišnje, a kod
onih sa normalnim nivoom TPOAb, skoro duplo manja, 2.6% godišnje
(38]. Stoga se po dijagnozi SKH, testovi tiroidne funkcije (TFT)
ponavljaju za 8-12 nedelja i dodatno se uradi merenje nivoa
tiroidnih autoantitela. Ukoliko perzistira SKH, TFT se ponavljaju na
6 meseci tokom prve dve godine praćenja, a potom jedanput godišnje,
ukoliko su nalazi stabilni. Nasuprot tome, ukoliko su TFT normalni
po ponovljenom određivanju, a pacijent nema simptome, strumu i
povišena tiroidna autoantitela, dalje praćenje nije neophodno [3].
POSTAVLJANJE DIJAGNOZE SUBKLINIČKOG HIPOTIROIDIZMA
Dijagnoza SKH se postavlja kada se kod pacijenta detektuju
povišene vrednosti TSH (referentni opseg većine testova je od 0.4 –
4.0 do 5 m IU/L ) uz normalne vrednosti FT4 u krvi [39]. Imajući u
vidu da se dijagnoza SKH zasniva na rezultatima laboratorijskih
analiza, treba uzeti u obzir specifičnost, senzitivnost i referentne
vrednosti primenjenog testa, pa u skladu sa tim tumačiti nalaz [40].
Iako je povišena koncentracija TSH u serumu najčešće znak primarne
hipotireoze, neophodno je znati da izmerene koncentracije mogu biti
povišene (obično <8 mU/L) kod osoba starijih od 65 godina bez
kliničkih i laboratorijskih dokaza bolesti štitaste žlezde [41].
Druga neka stanja, poput stanja nakon radioterapije vratne regije,
insuficijencija nadbubrežne žlezde, trudnoće, upotreba pojedinih
lekovi (litijum, AMD), ili prisustvo specifičnih antitela u krvi
(HAMA, ili makro TSH) mogu da imitiraju SKH [42–44]. Osim toga,
patološka gojaznost zbog efekta leptina na tireotropin oslobađajući
hormon (TRH) dovodi do reverzibilnog povišenja TSH u krvi [45].
Fluktuacije u koncentraciji TSH su očekivane kod akutnih, naročito
težih netiroidnih bolesti, kao i nakon operativnih zahvata –
hemitiroidektomije, što treba uzeti u obzir kod tumačenja
laboratorijskih nalaza [42,46]. Laboratorijsku dijagnostiku bi
trebalo odložiti 2-3 meseca nakon oporavka od akutnih bolesti zbog
efekata citokina na koncentraciju TSH, a suplementaciju biotinom
koji ulazi u sastav brojnih multivitamina (naročito onih koji se
preporučuju za zdravlje kose i noktiju) prekinuti najmanje 2 dana
pre obavljanja laboratorijskih analiza zbog interferencije sa
imunoesejima [42,47,48].
Postoje dve kategorije SKH prema stepenu povišenja TSH. Lako povišen
TSH, od 4-10 m IU/L koji se nalazi kod 80-90% pacijenta i znatnije
povišen TSH > 10 m IU/L [3]. Nakon postavljanja dijagnoze TSH, treba
pristupiti utvrđivanju uzroka, tj. postavljanju etiološke dijagnoze.
Dodatne laboratorijske analize u cilju postavljanja etiološke
dijagnoze su merenje tiroidnih autoantitela (TAT). TPOAb uglavnom,
zbog veće senzitivnosti i ređeTgAb, kao i ultrazvučni pregled
štitaste žlezde kojim se mogu otkriti karakteristične parenhimske
promene kod autoimunog tiroidita, koji je i najčešći uzrok SKH
[49,50].
Nivo TSH kod zdrave osobe ima male varijacije tokom vremena, oko 1/3
referentnog opsega, što se naziva sopstvenim „TSH setpoint-om“ koji
tokom napredovanja životne dobi ima tendenciju nalog porasta [51,
52]. Kod starijih osoba koristimo širi referentni opseg (4.0-7.0 m
IU/L), tj, lako povišen nivo TSH kod starijih se smatra fiziološkom
adaptacijom na starenje [41].
Kako kod zdravih, tako i kod osoba sa SKH, nivo TSH ima cirkadijalne
flktuacije serumskih koncentracija – najniža koncentracija je rano
popodne, sa oko 30% višim koncentracija uveče i preko noći.
Odloženi noćni pik TSH može se naći kod: radnika koji rade u noćnoj
smeni; onih koji imaju poremećaj spavanja; nakon težih fizičih
aktivnosti; kod poremećaja raspoloženja – depresije [3].
Biološki neaktivni oblici TSH mogu kod nekih osoba biti razlog
izmerenih viših vrednosti TSH [53].
Nivo TSH korelira sa BMI i markerima insulinske rezistencije pa je
nalaz TSH > 3.5 čest kod gojaznih [54].
KLINIČKE KARAKTERISTIKE SUBKLINIČKOG HIPOTIROIDIZMA
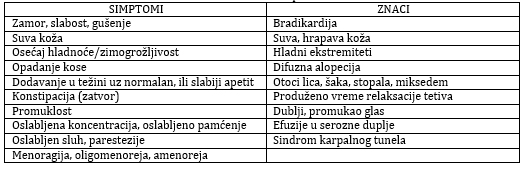
Simptomi
Po definiciji SKH je asimtomatsko stanje, bez kliničkih znakova
hipotiroidizma (Tabela 1). Međutim, da li je SKH zaista bez
simptoma? Neka istraživanja pokazuju da mali, ali statistički
značajan broj pacijenta sa SKH ima češće simptoma hipotiroidizma u
odnosu na zdrave i to: suvlju kožu, slabije pamćenje, sporije
mišljenje, slabije mišiće, brže umaranje, češće mišićne grčeve, veću
zimogrožljivost, dublji i promukliji glas, otečenije oči i češći
zatvor [5]. S druge strane, s obzirom da su simptomi i znaci
hipotiroidizma opšti i mogu se javiti i u drugim stanjima, neka
istraživanja pokazuju da nema poboljšanja simptoma kod pacijenta sa
SKH kada im se uvede supstitucije levotiroksinom [55]. Ipak, većina
pacijenata sa SKH nema hipotiroidne simptome.
Poremećaj raspoloženja i mentalnog zdravlja
Na osnovu mnogih istraživanja, čini se da mogu postojati blagi
poremećaji deklarativnog pamćenja (poznavanje činjenica),
proceduralnog pamćenja (veštine koje se obavljaju automatski) i
raspoloženja kod mlađih osoba sa SKH koji se poboljšavaju
supstitucijom levotiroksinom [56]. Međutim, takvi dokazi uglavnom
nisu nađeni u populaciji osoba starijih od 65 godina. [57].
Tabela 1. Simtomi i znaci hipotiroidizma
Gojaznost, glikoregulacija, insulinska rezistencija, dijabetes
melitus, dislipidemija
Nivo serumskog TSH u pozitivnoj je korelaciji sa telesnom težinom
[58] i pokazano je da za svaku jedinicu porasta log TSH, telesna
težina je za 2.3 kg veća kod žena i 1.1 kg kod muškaraca [59].
Nasuprot tome, znatan pad telesne težine je udružen sa padom nivoa
TSH [60]. Ipak, uzorčna veza između SKH i gojaznosti nije pokazana.
SKH bi mogao uticati na smanjenje insulinske senzitivnosti
delovanjem na pad broja glukoznih transportera u plazma membrani
(membrani ćelijskih organela) i direktnim dejstvom na lučenje i
klirens insulina, kao što je poznato da se dešava u hipotiroidizmu u
značajnom obimu [61]. Kod pacijenata sa utvrđenim diabetes melitusom
(DM) tip 2, promena glikemjske kontrole može da ukaže na SKH i druge
tiroidne poremećaje, dok je prevalenca SKH sa povišenim TAT kod
pacijenta sa DM tip 1 čak do 30% [62].
Velike epidemiološke studije su pokazale pozitivnu korelaciju između
nivoa TSH i dislipidemije što ukazuje na potencijalan uticaj SKH na
lipidni profil [5]. Slično tome, još jedno veliko istraživanje
pokazalo je npr. da je porast nivoa TSH za 1.0 m IU/L udružen s
prosečnim porastom nivoa ukupnog holesterola kod žena za 0.09 mmol,
što ukazuje na razlike uslovljene polom u odnosu između SKH i
lipidnog profila. Takođe, veza između nivoa TSH i lipidnog profila
je naglašenija sa napredovanjem životne dobi [63].
Kardiovaskularni sistem, srčana slabost i ishemijska bolest srca
SKH je udružena sa funkcijskim srčanim poremećajima, kao što su
dijastolna disfunkcija leve komore i snižena sistolna funkcija u
miru i fizičkom naporu [64]. Takođe su pokazane i vaskularne
abnormalnosti u ovom stanju, kao što su povećana vaskularna
rezistencija, krutost arterija, endotelna disfunkcija i
ateroskleroza [65]. Mnoga istraživanja ukazuju na SKH kao nezavisan
faktor rizika za razvoj srčane slabost, kao i za pogoršanje
postojeće [64].
Neki od rezultata istraživanja o uticaju na ishemijsku bolest srca
nisu pokazali udruženost AITB i ishemijske bolesti srca, ali
ponovnom analizom populacione Whickham studije [66], došlo se do
rezultata da je kod pacijenata sa SKH nađena značajno veća
učestalost srčanih ishemijskih događaja i mortaliteta usled
ishemijske bolesti srca. Slične rezultate je pokazala i metaanaliza
nekoliko relevantnih prospektivnih studija [67].
Stepen povišenja TSH
Rezultati studija pokazuju da nije beznačajno koliko je povišen TSH
u SKH. Postoje dve kategorije SKH prema stepenu povišenja TSH: lako
povšen TSH, od 4-10 m IU/L i znatnije povišen. TSH> 10 m IU/L.
Simptomi, manifestacije i potencijalne komplikacije, uključivši
poremećaje endotela, lipida i kardiovaskularne poremećaje, u vezi su
sa stepenom povišenja TSH, ali zavise i od pola i životne dobi [68].
Rezultati brojnih završenih kao i studija koje su u toku, biće
korisni da se utvrdi, kako prag TSH, tako i prag životne dobi za
razmatranje terapijske intervencije tj. supstitucije levotiroksinom.
TERAPIJSKI PRISTUP KOD SUBKLINIČKOG HIPOTIROIDIZMA
SKH se, kao i KH, leči supstitucijom levotiroksinom. Cilj
lečenja, kao i kod KH, treba da bude otklanjanje simtoma
hipotiroidizma postizanjem normalizacije TSH [69].
Međutim, s obzirom da se po definiciji radi o asimtomatskom
poremećaju kod većine pacijenata, poremećaju samo na nivou krvi, pri
donošenju odluke o lečenju treba da imamo na umu dva pitanja:
-kakav je uticaj lečenja levotiroksinom na dugoročne kliničke ishode
kod pacijenata sa SKH?
-kakav je ishod praćenja bez lečenja levotiroksinom na dugoročne
ishode kod pacijenata sa SKH [70]? Postojeći vodiči za lečenje SKH
razlikuju se među sobom, s obzirom da postoje oprečni dokazi o
koristi od dugoročne supstitucije levotiroksinom u ovom stanju. Iako
postoje podaci iz više sveobuhvatnih pregleda o kliničkim ishodima
lečenja SKH, još uvek se nije došlo do konačnog zaključka o koristi
od ovakvog pristupa [1]. Svakako, kao što je naglašeno u prethodnom
tekstu, pre započinjanja supstitucije treba za 3 meseca od
postavljanja dijagnoze SKH, ponoviti testiranje TSH. Ovo je važno
jer se kod oko 60% pacijenata TSH normalizuje unutar 3 meseca, a kod
oko 62% tokom 5 godina [71,44]. S druge strane, kod pacijenata sa
SKH i hipotirodinim simptomima, treba najpre razmotriti druge moguće
uzroke za postojeće simptome.
Prema većini vodiča, supstituciju levotiroksinom kod SKH treba
započeti kada je TSH >10 mIU/L, bez obzira na odsustvo simtpoma.
Supstituciju levotiroksinom treba razmotiriti u slučajevima u kojima
je TSH između 5–10 mIU/L u ponovljenim merenjima i postoje simptomi
slični hipotiroidizmu. Međutim, ukoliko se simptomi ne povuku nakon
3-4 meseca supstitucije levotiroksinom i normalizacije TSH, trebalo
bi prekinuti lečenje [70, 1]. U ostalim slučajevima, odluku o
lečenju SKH, kada je TSH između 5–10 mIU/L u ponovljenim merenjima,
treba prilagoditi individualno u zavisnosti od starosti,
komorbiditeta, stepena povišenja TSH, perzistentnosti i progresije
povišenja TSH, prisustva TAT i prisustva strume. Smisao supstitucije
bi se zasnivao na smanjenju rizika neželjenih KV događaja i
eventualnom sprečavanju progresije ka KH. Pri tome treba imati na
umu da supstitucija levotiroksinom može dovesti do jatrogene
subkliničke/kliničke tirotoksikoze, pogotovo kod starijih
pacijenata, što samo po sebi može biti rizik pogoršanja KV stanja i
nema dokaza da je supstitucija korisna kod osoba sa 65 godina i
starijih [42]. Faktori koji opredeljuju za terapiju levotiroksinom
su dakle: klinička proba zbog simptoma hipotiroidizma, želja
pacijenta, bipolarni poremećaj, depresija, neplodnost/ovulatorna
disfunkcija, prisustvo TAT, progresivni porast TSH, trudnoća, ili
planiranje trudnoće, deca, adolescenti.
PREPORUKE [3]
- Postoje dve kategorije SKH prema nivou TSH: Lako povišen TSH
– 4-10 m IU/L koji se nalazi kod 90% osoba sa SKH; i TSH> 10 m
IU/L
- Nalaz povišenog TSH uz normalan FT4 u prvom merenju, treba
ponoviti za 2-3 meseca, ponovnim merenjem TSH, T4 i TPOAb
- Osobama sa povišenim TPOAb/TgAb i/ili ultrazvučnim nalazom
koji ukazuje na AIT, treba uraditi merenje TSH i FT4
- Za postavljanje dijagnoze SKH u starijoj populaciji treba
koristiti za životnu dob specifične referentne opsege.
- Kod pacijenata mlađih od 65 godina i TSH > 10 m IU/L, čak i
u odsustvu simptoma hipotiroidizma, preporučuje se uvođenje
supstitucije L-tiroksinom.
- Kod pacijenata mlađih od 65 godina koji imaju simptome
hipotiroidizma i TSH < 10 m IU/L, razmotriti kliničku probu
uvođenjem supstitucije L-tiroksinom.
- Nakon hemitiroidektomije, perzistentni SKH treba lečiti
L-tiroksinom u cilju normalizacije TSH.
- Pacijente sa difuznom, ili nodoznom strumom i perzistentnim
SKH, treba lečiti L-tiroksinom u cilju normalizacija TSH.
- Kod pacijenta sa DM tip 1, nivo TSH treba pratiti jedanput
godišnje.
- Kod pacijenata sa DM tip 2 i neobjašnjivim pogoršanjem
glikemijske kontrole, treba uraditi TSH i FT4.
- Ograničeni su dokazi da supstitucija L-tiroksinom kod mlađih
osoba sa SKH dovodi do poboljšanja mentalne funkcije.
- Nema dokaza za korisne efekte terapije L-tiroksinom kod
gojaznh osoba sa TSH < 10 m IU/L i normalnim FT4 na smanjenje
telesne težine.
- Terapija L-tiroksinom kod SKH može sniziti i ukupni i LDL
holesterol, ali se normalizacija lipida retko postiže.
- Efekat supstitucije L-tiroksinom na koncentracije serumskih
lipida je najizraženiji kod pacijenta sa nivoima TSH > 10 m IU/L
pre lečenja.
- Osobe preko 80 godina starosti, sa nivoom TSH ≤ 10 m IU/L,
pažljivo pratiti, izbegavajući uvođenje supstitucije
L-tiroksinom.
- Ako su u kontrolnom testiranju hormoni normalni, uz normalan
nivo TAT i odsustvo strume – nije potrebno dalje testiranje.
- Ako perzistira SKH i nije započeta terapija L-tiroksinom,
hormone testirati na 6 meseci najmanje tokom prve 2 godine, a
potom jedanput godišnje.
TRUDNOĆA I SUBKLINIČKI HIPOTIROIDIZAM
SKH u trudnoći definiše se kao stanje u kome je serumski TSH
viši od gornje granice referentnog opsega specifičnog za trimestar
trudnoće, dok su serumski T4 i T3u referentnim opsezima
[72,73,14,74]. Javlja se kod otprilike 2-2.5% trudnica, s tim što u
je u pojedinim državama taj broj znatno veći (u severnoj Španiji čak
13.7%) [75].
Izolovana hipotiroksinemija se definiše kao koncentracija FT4 u
serumu ispod 2.5 percentila od referentnog opsega (0.80 ng/dL;
10.30pmol/L), uz normalnu koncentraciju TSH [72,12].
Dijagnoza SKH u trudnoći postavlja se jedino na osnovu
laboratorijskih analiza, pošto su simptomi i znaci nespecifični i
veoma slični tegobama koje mogu biti povezane sa varijacijama u
načinu života, ili tegobama koje su posledica mnogih drugih stanja
kao i same trudnoće [72,12,74]. Referentni opseg TFT kod trudnica
se razlikuje od referntnog opsega opšte populacije, a takođe se
razlikuje i po trimestrima trudnoće.Na osnovu objavljenih studija,
uglavnom zapadnih zemalja, predložen je sledeći referentni opseg za
TSH u trudnoći: prvi trimester 0.1 - 2.5 mU/L; drugi trimestar 0.2 –
3.0 mU/L; treći trimestar 0.3–3.5 mU/L [76-78]. Međutim, savetuje
se određivanje ovih vrednosti za svaku državu, odnosno region
ponaosob. Treba napomenuti da tokom trudnoće dolazi do povećanja
koncentracije T4 koja je najviša tokom prvog trimestra trudnoće, dok
je to povećanje znatno manje tokom drugog i trećeg trimestra. Uprkos
povećanom vezivanju hormona za transportne protein, koji su takođe
povećani u trudnoći, mnogi autori smatraju da je pouzdanost
određivanja slobodnog tiroksina (FT4) standardnim imunoesejom za FT4
zadovoljavajuća [72,12].
Kako se definicija SKH zasniva na povišenom nivou TSH u kombinaciji
sa normalnim vrednostima FT4, bilo bi od ključnog značaja odrediti
refernetni opseg TH specifičnih za trimester. Dostupni podaci iz
literature ukazuju da je u prvom trimestru trudnoće donja granica
FT4 2.5-ti percentil referentnog opsega detektovan imunoesejom
iznosi oko 0.80 ng/Dl (10.30pmol/L) [72,12]. Kako bi dobili
referentnu vrednost specifičnu za prvi trimester trudnoće, neki
autori predlažu da se normalne vrednosti ukupnog, za transportne
proteine vezanog T4 (TT4), koje iznose 5–12 mg/dL, ili 50–150 nmol/L
za žene koje nisu trudne, pomnože sa 1.5 i tako dobijene vrednosti
koriste kao referentne vrednosti specifične za prvi trimester
[72,12].
Antitela na tiroidnu peroksidazu (TPOAb) prisutna su kod oko 50%
trudnica sa SKH, a čak i do 80% kod trudnica sa kliničkim
hipotiroidizmom. Kod trudnica sa SKH određivanje TPOAb se
preporučuje u cilju utvrđivanja AITB. Antitela na tireoglobulin
(TgAb) ne treba zanemariti. Kod 5% žena sa SKH i normalnim TPOAb,
pronađena su povišena TgAb. Žene sa povišenim TgAb, a normalnim
TPOAb, imale su značajno viši nivo TSH u serumu u poređenju sa
ženama bez AITB tako da kod trudnica sa negativnim TPOAb treba
odrediti i TgAb. Nakon prvog trimestral TAT mogu biti negativna zbog
imunosupresije tokom trudnoće, te u prisustvu povišenih vrednosti
TSH i negativnih antitela, treba uraditi i ultrazvuk štitaste žlezde
[72,12].
Neželjeni efekti SKH tokom trudnoće
Ispoljeni, klinički hipotiroidizam tokom trudnoće jasno je povezan
sa neželjenim događajima kao što su preeklampsija, eklampsija,
gestacijska hipertenzija, kretenizam, smrt fetusa i spontani
pobačaji. Međutim, manje je dokaza o komplikacijama tokom trudnoće i
SKH. Studije koje se bave ovim problemom pokazuju oprečne rezultate.
Većina studija ukazuje na povećan rizik od gestacijskog dijabetesa
(GD), sa pozitivnom korelacijom između nivoa TSH i rizika od GD.
Nekoliko studija je potvrdilo povezanost SKH sa spontanim
pobačajima, veoma ranim gubitkom embriona, gestacijskom
hipertenzijom i preeklampsijom. Rizik od prevremenog porođaja,
takođe je prisutan kod trudnica sa SKH. Ostale komplikacije koje se
pominju kao moguće, ali dosta retke jesu: abrupcija placente,
povišen perinatalni mortalitet, nizak Apgar rezultat i niska
porođajna težina. Međutim, povezanost između SKH u trudnoći i
poremećaja psihomotornog razvoja potomstva nije u potpunosti
dokazana [72,12].
Efekti lečenja SKH tokom trudnoće
Smatra se da lečenje SKH levotiroksinom ima potencijalne koristi
koje su veće od potencijalnih rizika. SKH koja nastaje pre začeća,
ili tokom gestacije, treba lečiti levotiroksinom. Nasuprot tome,
nema studija koje pokazuju korist od lečenja izolovane
hipotiroksinemije tokom trudnoće u pogledu akušerskih komplikacija
majke. Međutim, terapija levotiroksinom može se razmotriti kod
izolovane hipotiroksinemije otkrivene u prvom trimestru trudnoće,
zbog povezanosti sa povoljnijim neuropsihološkim razvojem kod dece.
Terapija levotiroksinom se ne preporučuje u izolovanim slučajevima
hipotiroksinemije otkrivene u drugom i trećem trimestru.
Kod pacijntkinja kod kojih je u prvom trimestru TSH > 10 mU/l,
nezavisno od prisustva TPOAb, treba započeti terapiju
levotiroksinom. Isto tako, terapiju treba započeti i kod trudnica
kod kojih je TSH > 4 mU/L i kod kojih su pozitivna TPOAb. Terapiju
treba razmotriti kod trudnica kod kojih je TSH od 2.5-4mU/L sa
pozitivnim TPOAb i kod trudnica sa vrednostima TSH od 2.5-10mU/L sa
negativnim TPOAb. Kod pacijentkinja koje se pripremaju za trudnoću
asistiranom reproduktivnom tehnikom, TSH treba da je < 2,5mU/L. Kod
ovih pacijentkinja TSH treba određivati dve nedelje pre i dve
nedelje nakon inseminacije i vantelesne oplodnje (VTO) [79].
Ako se donese odluka o uvođenju supstitucije kod trudnica sa SKH,
predložene doze levotiroksina su: 1.20 µg/kg/dan za TSH ≤ 4.2 mU/L;
1.42 µg/kg/dan za TSH >4.2–10 m IU/L i 2.33 µg/kg/dan za TSH > 10
mU/L. Vrednosti TSH treba proveravati svakih 4-6 nedelja tokom prvog
trimestra i jednom tokom drugog i trećeg trimestra.
Kod pacijentkinja sa jutarnjom mučninom, primena levotiroksina kasno
uveče može biti legitimna opcija. Cilj lečenja levotiroksinom tokom
trudnoće je normalizacija vrednosti TSH u serumu majke unutar
referntnih vrednosti specifičnih za trimestar trudnoće.
Većina slučajeva SKH u trudnoći je prolazna i oporavlja se nakon
trudnoće. Međutim, kod trudnica sa pozitivnim TPOAb i TSH > 5 mU/L,
velika je verovatnoća da će imati stalno povišen TSH, odnosno da
će se hipotireoidizam zadržati i nakon trudnoće. Nakon porođaja doza
levotiroksina treba da bude smanjena na dozu pre začeća. Kod žena
sa dijagnozom SKH tokom trudnoće, kod kojih je TSH < 5 mU/L i koje
imaju negativna TPOAb, kao i kod žena čija je supstituciona doza
bila manja od 50 µg levotiroksina, može se pokušati prekid
supstitucije nakon porođaja, s tim što treba proveriti tiroidini
status 6 nedelja nakon porođaja, potom na 6 i 12 meseci. Kod ostalih
žena sa dijagnozom SKH nakon trudnoće, treba proveriti tiroidni
status 6 meseci i godinu dana po porođaju i utvrditi potrebu za
supstitucijom. Terapija levotiroksinom za eutiroidne žene sa
pozitivnim antitelima se ne savetuje [72,12]. Dokazi za skrining na
SKH u trudnoći su dvosmisleni. Iako još uvek nema dobro
kontrolisanih studija da bi se opravdao opšti skrining, veliki broj
autora preporučuje skrining. Takođe, veliki broj autora zagovara
skrinig samo kod trudnica koje su u posebnom riziku tj. žene sa
anamnezom o tiroidnim bolestima, žene sa porodičnom anamnezom o
tiroidnim bolestima, žene sa strumom, žene DM tip 1, žene sa drugim
autoimunim bolestima, žene s infertilitetom nepoznatog uzroka, žene
s anamnezom o radioterapiji glave i vrata, žene s anamnezom o
ranijem pobačaju i preranom porođaju [72,12,74,80].
SUBKLINIČKI HIPOTIROIDIZAM KOD DECE
Predmet razmatranja je prevashodno SKH kod odrasle populacije,
ali uključiće se i nekoliko napomena o ovom stanju kod dece. Kada se
radi o mogućem prenatalnom uticaju, rezultati mnogobrojnih
istraživanja o vezi između SKH majke i oštećenog neurofiziološkog
razvoja deteta nisu konzistentni, kao što je to veoma jasno kod KH
[12], te su neophodna dalja istraživanja kako bi se tačan uticaj
odredio. Kod novorođenčadi i u periodu ranog detinjstva, posebno u
prve 3 godine života, TH imaju nezamenjivu ulogu u procesu
sazrevanja i ravoja mozga, a uticaj na linearni rast perzistira do
zatvaranja epifiza u adolescenciji [81]. Po porođaju se dešavaju
velike promene u tirodinoj funkciji kod novorođenčeta, a nivo TSH >
5 mU/L, može se smatrati povišenim nakon 1 meseca života. Stoga je
neophodno, kao i kod starije populacije, za tumačenje dijagnostičkih
biohemijskih nalaza koristiti za uzrast specifične referentne
vrednosti [82]. U opštoj dečijoj i adolescentnoj populaciji sa SKH,
hormoni se normalizuju kod preko 70% njih, ili perzistiraju
nepromenjeni kod većine preostalih, tokom narednih 5 godina od
postavljanja dijagnoze [12]. SKH je 10 puta češći kod dece sa
Daunovim sindromom nego u opštoj populaciji [83]. Kod gojazne dece,
nivo TSH od 5-7 m IU/L je verovatno posledica, a ne uzrok gojaznosti
[84]. U područjima sa dovoljnim unosom joda, SKH kod mlađe dece je
najčešće idiopatski (tzv. perzistentna „Hypertirotropinemija“ i
„Ne-autoimuni“ idipopatski SKH), ili izazvan različitim perinatalnim
i genetskim uzrocima. Kod starije dece i adolescenata, najčešći
uzrok je AITB [12]. Za sada nema dovoljno dokaza da bi se kod većine
dece sa SKH i TSH <10 mU/L preporučila supstitucija levotiroksinom
[85].
AMIODARONOM INDUKOVAN SUBKLINIČKI HIPOTIROIDIZAM
Hronična terapija amiodaronom (AMD), antiaritmikom bogatim jodom,
udružena je sa pojavom predvidljivih promena u TFT, kao i pojavom
tirodinih disfunkcija, za čiji nastanak je odgovorno, kako
opterećenje jodom, tako i cititoksičnost samog antiaritmika [86].
Prema istraživanjima autora ovog rada, amiodaronom indukovani
subklinički hipotiroidizam (AISKH) se na području sa dovoljnim
unosom joda, nalazi kod 10% kardioloških pacijenata lečenih ovim
antiarimikom, češće kod žena, pacijenata sa uvećanom štitastom
žlezdom i pacijenata sa povišenim TPOAb [87]. Kod većine pacijenata
sa AISKH, stanje ne progedira ka KH, a kod velikog broja dolazi do
spontane normalizacije tiroidnog statusa, čak i uz nastavak terapije
amiodaronom [88]. Opisan je i slučaj amiodaronom indukovane
tirotoksikoze (AIT) nakon AISKH kod pacijenta tokom nastavka
terapije amiodaronom [89]. Takođe, tokom oporavka od AIT može se
razviti SKH, prolazna, ali i trajna [87,89]. Preporuka je da pre
uvođenja terapije amiodaronom treba utvrditi tiroidni status i
redovno ga kontrolisati (najčešće na 6 meseci) tokom terapije ovim
antiaritmikom. Kod pacijenata sa povećanim rizikom za tiroidnu
disfunkciju, to jest kod žena, pacijenata sa strumom i sa povišenim
TAT, treba razmotriti mogućnost primene drugog antiaritmika, ili
češće kontrolisati tiroidni status. Smatramo da kod AISKH nije
neophodno ukidati terapiju amiodaronom, već nastaviti redovno
praćenje tiroidnog statusa [90,91].
MIKRONUTRIJENTI I SUBKLINIČKI HIPOTIROIDIZAM
Životne navike uključujući san, pušenje, ishranu i fizičku
aktivnost su značajni faktori koji utiču na normalnu funkciju štitne
žlezde u SKH [92]. Jod, selen i gvožđe su neophodni za sintezu
hormona štitne žlezde. Hem-vezano gvožđe ulazi u sastav tiroidne
peroksidaze (TPO) koja omogućava ugradnju atoma joda u molekule
tirozina u procesu sineteze hormona štitne žlezde [93].
Mio-inozitol, kao sekundarni glasnik fosfolipaze C, takođe stimuliše
organifikaciju joda i njegovu ugradnju u hormone štitne žlezde kroz
inozitol fosfat/Ca2+/diacilglicerol signalni put [94].. Selen
(dnevne potrebe su 55 µg, a u trudnoći i tokom laktacije 60-70 µg)
kao integralni deo enzima dejodinaze, omogućava sintezu
trijodtironina, ili inaktivaciju tiroksina prevođenjem u reverzni
T3. Dodatno, selenoproteini, glutation peroksidaza i tioredoksin
reduktaza, kroz efekte na koncentraciju reaktivnih vrsta kiseonika,
naročito H2O2, utiču na organifikaciju joda [93].
Adekvatan unos joda (oko 150 μg dnevno), kao i adekvatna sinteza TSH
su osnovni preduslovi za sintezu hormona štitne žlezde. Nedostatak
joda u ishrani dovodi do smanjene sinteze hormona štitne žlezde, ali
isti efekat ima i njegov preteran unos, zbog Wolff-Chaikoff-ljevog
efekta [94]. Zbog efekta na organifikaciju joda, nedostatak gvožđa
(dnevne potrebe su oko 9 mg za muškarce i oko 15 mg za žene koje
menstruiraju) utiče na tiroidni status kao i nedostatak
mio-inozitola, koji se za razliku od gvožđa, selena i joda, ipak
može sintetisati u organizmu iz glukoze, pa su deficiti retki
[94,95]. Kod kombinovanog deficita joda i selena u cilju
normalizacije funkcije štitne žlezde neophodno je najpre nadoknaditi
deficit joda, pa tek nakon toga deficit selena [94,96].
ZAKLJUČAK
SKH je često stanje i kod većine ne zahteva lečenje, već samo
praćenje. Postoji konsenzus da supstituciju levotiroksinom treba
indikovati kod odraslih pacijenata sa SKH čiji je TSH ≥ 10 m IU/L. U
svim ostalim slučajevima, procena je individualna. Preporuke u
pogledu skrininga na SKH veoma se razlikuju među stručnim
udruženjima i ekspertskim grupama. Ukupno gledano, ne preporučuje se
skrining u opštoj populaciji i treba ga ograničiti na osobe sa
visokim rizikom za postojanje ovog stanja, kao što su pacijenti sa
autoimunim bolestima, pozitivna lična, ili porodična anamneza na
tiroidna oboljenja, te na one sa simptomima slIčinim hipotiroidizmu.
Čak i kod asimtomatskih trudnica, mišljenja o potrebi univerzalnog
skrininga su podeljena. Najveći broj stručnih udruženja predlaže
ciljani skrining samo određenih grupa pacijenata.
LITERATURA:
- Bauer SB, Azcoaga-Lorenzo A, Agrawal U, McCowan C.
Management strategies forpatients with subclinical
hypothyroidism: a protocol for an umbrella review. Syst Rev
2021;10:290. https://doi.org/10.1186/s13643-021-01842-y BMC
- Surks MI, Ortiz E, Daniels GH, Sawin CT, Col NF, Cobin RH,
et al. Subclinicalthyroid disease: scientific review and
guidelines for diagnosis and management. Jama. 2004;291:228–38.
- Simon H.S. Pearce HSS, Brabant G, Duntas HL, Monzani F,
Peeters PR, Salman Razvi S, Wemeau JL. 2013 ETA Guideline:
Management of Subclinical Hypothyroidism. Eur Thyroid J
2013;2:215–228. DOI: 10.1159/000356507
- Gharib H, Tuttle MR, H. Baskin J, Fish HL, Singer AP,
McDermott TM. Consensusstatement: Subclinical Thyroid
Dysfunction: A Joint Statement on Management from the American
Association of Clinical Endocrinologists,the American Thyroid
Association, and The Endocrine Society. J Clin Endocrinol Metab
2005; 90(1):581–585.
- Canaris GJ, Manowitz NR, Mayor G, Ridgway EC: The Colorado
thyroid disease prevalence study. Arch Intern Med 2000; 160:
526–534.
- Vanderpump MP, Tunbridge WM, French JM, et al: The incidence
of thyroid disorders in the community: a twenty-year follow-up
of the Whickham Survey. Clin Endocrinol 1995; 43: 55–68.
- Hollowell JG, Staehling NW, Flanders WD, Hannon WH, Gunter
EW, Spencer CA, Braverman LE. Serum TSH, T(4), and thyroid
antibodies in the United States population (1988 to 1994):
National Health and Nutrition Examination Survey (NHANES III) J
Clin Endocrinol Metab. 2002;87:489–499.
- Zimmermann BM, Boelaert K. Iodine deficiency and thyroid
disorders. Lancet Diabetes Endocrinol 2015;3:286–95.
http://dx.doi.org/10.1016/ S2213-8587(14)70225-6
- Uzunlulu M, Yorulmaz E, Oguz A. Prevalence of Subclinical
Hypothyroidism in Patients with Metabolic Syndrome. Endocrine
Journal 2007;54(1):71–76.
- Han C, He X, Xia X, Li Y, Shi X, Shan Z, Teng W.Subclinical
Hypothyroidism and Type 2 Diabetes: A Systematic Review and
Meta-Analysis.PLoS One. 2015;10(8):e0135233.
- Chonchol M, LippiG, Salvagno G, Zoppini G, Muggeo M, Targher
GConclusions: These findings suggest that subclinical primary
hypothyroidism is a relatively common condition (∼18%) among
persons with CKD not requiring chronic dialysis, and it is
independently associated with progressively lower estimated GFR
in a large cohort of unselected outpatient adults.. Prevalence
of Subclinical Hypothyroidism in Patients with Chronic Kidney
Disease. Clin J Am Soc Nephrol. 2008; 3(5):1296–1300. doi:
10.2215/CJN.00800208
- Lazarus J, Brown SR, Daumerie C, Hubalewska-Dydejczyk A,
Negro R, Vaidya B. Guidelines for the Management of Subclinical
Hypothyroidism in Pregnancy and in Children. Eur Thyroid J
2014;3:76–94. DOI: 10.1159/000362597
- Surks IM, Boucai L. Age- and Race-Based Serum Thyrotropin
Reference Limits. J Clin Endocrinol Metab 2010;95(2):496–502.
https://doi.org/10.1210/jc.2009-1845
- Hennessey VJ, Espaillat R. Subclinical hypothyroidism: a
historical view and shifting prevalence. Int J Clin Pract. 2015;
69(7):771–782. doi: 10.1111/ijcp.12619
- Dittmar M, Kahaly GJ. Polyglandular autoimmune syn-dromes:
immunogenetics and long-term follow-up. J Clin Endocrinol Metab.
2003;88:2983-2992.
- Broadley SA, Deans J, Sawcer SJ, Clayton D, Compston DA.
Autoimmune disease in first-degree relatives of patients with
multiple sclerosis. A UK survey. Brain. 2000;123:1102-1111.
- Heward J, Gough SC. Genetic susceptibility to the
development of autoimmune disease. Clin Sci (Lond). 1997;93:
479-491.
- Menconi F, Monti MC, Greenberg DA, et al. Molecular amino
acid signatures in the MHC class II peptide-binding pocket
predispose to autoimmune thyroiditis in humans and in mice. Proc
Natl Acad Sci USA. 2008;105:14034-14039.
- Ban Y, Greenberg DA, Davies TF, Jacobson E, Concepcion E,
Tomer Y. Linkage analysis of thyroid antibody production:
evidence for shared susceptibility to clinical autoimmune
thyroid disease. J Clin Endocrinol Metab. 2008;93:3589-3596.
- Andersson M, de Benoist B, Delange F, Zupan J. Prevention
and control of iodine deficiency in pregnant and lactating women
and in children less than 2-years-old: conclusions and
recommendations of the Technical Consultation. Public Health
Nutr. 2007;10:1606-1611.
- Emerson CH, Dysno WL, Utiger RD. Serum thyrotropin and
thyroxine concentrations in patients receiving lithium
carbonate. J Clin Endocrinol Metab. 1973;36:338-346.
- Preziati D, La Rosa L, Covini G, et al. Autoimmunity and
thyroid function in patients with chronic active hepatitis
treated with recombinant interferon alpha-2a. Eur J Endocrinol.
1995;132:587-593.
- Martino E, Bartalena L, Bogazzi F, Braverman LE. The effects
of amiodarone on the thyroid. Endocr Rev. 2001;22:240-254.
- Kappers MH, van Esch JH, Smedts FM, de Krijger RR, et al.
Sunitinib-induced hypothyroidism is due to induction of type 3
deiodinase activity and thyroidal capillary regression. J Clin
Endocrinol Metab. 2011;96:3087-3094.
- Santen RJ, Misbin RI. Aminoglutethimide: review of
pharmacology and clinical use. Pharmacotherapy1981;1(2):95-120.
- Matveyeva SL, Shevchenko OS, Pogorelova OO. The function of
the thyroid gland in patients with multi-drug resistant
tuberculosis. Antimicrobial Resistance and Infection Control
2017;6:82-84. DOI 10.1186/s13756-017-0238-4
- Moreno DM, Miguélez González M, González Fernández L,
Percovich Hualpa HC. A review of systemic infiltrative diseases
and associated endocrine diseases
Endocrinología,DiabetesyNutrición (English ed.) 2021;68:312-320.
- Ozen Oz Gul, Soner Cander, Canan Ersoy. . An uncommon
infiltrative disease of thyroid: Riedel's thyroiditis. Endocrine
Abstracts 2014; 35:P282. DOI: 10.1530/endoabs.35.P282
- Payami H, Joe S, Thomson G. 1989 Autoimmune thy-roid disease
in type I diabetic families. Genet Epidemiol. 1989;6:137-141.
- Nerup J. Addison’s disease—clinical studies. A report of 108
cases. Acta Endocrinol (Copenh). 1974;76:127-141.
- Torfs CP, King MC, Huey B, Malmgren J, Grumet FC. Genetic
interrelationship between insulin-dependent diabetes mellitus,
the autoimmune thyroid diseases, and rheumatoid arthritis. Am J
Hum Genet. 1986;38:170-187.
- Murdoch JC, Ratcliffe WA, McLarty DG, Rodger JC, Ratcliffe
JG. Thyroid function in adults with Down’s syndrome. J Clin
Endocrinol Metab. 1977;44:453-458.
- Radetti G, Mazzanti L, Paganini C, et al. Frequency,
clinical and laboratory features of thyroiditis in girls with
Turner’s syndrome. The Italian Study Group for Turner’s
Syndrome. Acta Paediatr. 1995;84:909-912.
- Mouat F, Evans HM, Cutfield WS, Hofman PL, Jefferies C.
Massive hepatic hemangioendothelioma and consumptive
hypothyroidism. J Pediatr Endocrinol Metab. 2008;21:701-703.
- Robin P. Peeter. Subclinical Hypothyroidism. N Engl J Med
2017;376:2556-2565. DOI: 10.1056/NEJMcp1611144
- Huber G, Staub JJ, Meier C, et al: Prospective study of the
spontaneous course of subclinicalhypothyroidism: prognostic
value of thyrotropin, thyroid reserve, and thyroid antibodies. J
Clin Endocrinol Metab 2002;87:3221–3226.
- Diez JJ, Iglesias P: Spontaneous subclinical hypothyroidism
in patients older than 55 years: an analysis of natural course
and risk factors for the development of overt thyroid failure. J
Clin Endocrinol Metab 2004; 89:4890–4897.
- Meyerovitch J, Rotman-Pikielny P, Sherf M, et al: Serum
thyrotropin measurements in the community: five-year follow-up
in a large network of primary care physicians. Arch Intern Med
2007;167:1533–1538.
- Walsh JP, Bremner AP, Feddema P, et al. Thyrotropin and
thyroid antibodies as predictors of hypothyroidism: a 13-year,
longitudinal study of a community-based cohort using current
immunoassay techniques. J. Clin. Endocrinol. Metab.
2010;95:1095–1104.
- Kalaria T, Sanders A, Fenn J, et al. The diagnosis and
management of subclinical hypothyroidism is assay-dependent–
Implications for clinical practice. Clin. Endocrinol. (Oxf).
2021;94:1012–1016.
- Surks MI & Hollowell JGAge-specific distribution of serum
thyrotropin and antithyroid antibodies in the US population:
implications for the prevalence of subclinical hypothyroidism.
J. Clin. Endocrinol. Metab. 2007;92:4575–4582.
- Biondi B, Cappola AR & Cooper DS. Subclinical
Hypothyroidism: A Review. JAMA 2019;322:153–160.
- Hattori N, Ishihara T, Yamagami K, et al. Macro TSH in
patients with subclinical hypothyroidism. Clin. Endocrinol.
(Oxf). 2015;83:923–930.
- Koulouri O, Moran C, Halsall D, et al. Pitfalls in the
measurement and interpretation of thyroid function tests. Best
Pract. Res. Clin. Endocrinol. Metab. 2013;27:745.
- Santini F, Marzullo P, Rotondi M, et al. Mechanisms in
endocrinology: the crosstalk between thyroid gland and adipose
tissue: signal integration in health and disease. Eur. J.
Endocrinol. 2014;171:R137–R152.
- Kim WG, Park S, Jeon MJ, et al. Clinical Features of Early
and Late Postoperative Hypothyroidism After Lobectomy. J. Clin.
Endocrinol. Metab. 2017;102:1317–1324.
- Ardabilygazir A, Afshariyamchlou S, Mir D, et al. Effect of
High-dose Biotin on Thyroid Function Tests: Case Report and
Literature Review. Cureus 2018;10.
- Katzman BM, Lueke AJ, Donato LJ, et al. Prevalence of biotin
supplement usage in outpatients and plasma biotin concentrations
in patients presenting to the emergency department. Clin.
Biochem. 2018;60:11–16.
- Garber JR, Cobin RH, Gharib H, et al: Clinical practice
guidelines for hypothyroidism in adults: cosponsored by the
American Association of Clinical Endocrinologists and the
American Thyroid Association. Thyroid 2012;22:1200–1235.
- Pedersen OM, Aardal NP, Larssen TB, et al: The value of
ultrasonography in predicting autoimmune thyroid disease.
Thyroid 2000;10:251–259.
- Andersen S, Pedersen KM, Bruun NH, Laurberg P: Narrow
individual variations in serum T 4 and T 3 in normal subjects: a
clue to the understanding of subclinical thyroid disease. J Clin
Endocrinol Metab 2002;87:1068–1072.
- Bremner AP, Feddema P, Leedman PJ, et al: Age-related
changes in thyroid function: a longitudinal study of a
community-based cohort. J Clin Endocrinol Metab 2012;97:
1554–1562.
- Persani L, Borgato S, Romoli R, et al: Changes in the degree
of sialylation of carbohydrate chains modify the biological
properties of circulating thyrotropin isoforms in various
physiological and pathological states. J Clin Endocrinol Metab
1998;83:2486–2492.
- Asvold BO, Bjoto T, Vatten LJ: Association of serum TSH with
high body mass differs between smokers and never-smokers. J Clin
Endocrinol Metab 2009;94:5023–5027.
- Villar HC, Saconato H, Valente O, Atallah AN: Thyroid
hormone replacement for subclinical hypothyroidism. Cochrane
Database Syst Rev 2007;3:CD003419.
- Samuels MH, Schuff KG, Carlson NE, et al: Health status,
mood, and cognition in experimentally induced subclinical
hypothyroidism. J Clin Endocrinol Metab 2007;25:2545– 2551.
- Parle J, Roberts L, Wilson S, et al: A randomized controlled
trial of the effect of thyroxine replacement on cognitive
function in community- living elderly subjects with subclinical
hypothyroidism: the Birmingham Elderly Thyroid Study. J Clin
Endocrinol Metab 2010;95:3623–3632.
- Kitahara CM, Platz EA, Ladenson PW, et al: Body fatness and
markers of thyroid function among US men and women. PLoS One
2012;7:e34979.
- Fox CS, Pencina MJ, D’Agostino RB, et al: Relations of
thyroid function to body weight: cross-sectional and
longitudinal observations in a community-based sample. Arch
Intern Med 2008;168:587–592.
- Wolters B, Lass N, Reinehr T: TSH and freetriiodothyronine
concentrations are associated with weight loss in a lifestyle
interventionand weight regain afterwards in obese children. Eur
J Endocrinol 2013;168:323–329.
- Maratou E, Hadjidakis DJ, Kollias A, et al: Studies of
insulin resistance in patients with clinical and subclinical
hypothyroidism. Eur J Endocrinol 2009;160:785–790.
- Triolo TM, Armstrong TK, McFann K, et al: Additional
autoimmune disease found in 33% of patients at type 1 diabetes
onset. Diabetes Care 2011;34:1211–1213.
- Tognini S, Polini A, Pasqualetti G, et al: Age and gender
substantially influence the relationship between thyroid status
and the lipoprotein profile: results from a large
cross-sectional study. Thyroid 2012;22:1096–1103.
- Biondi B: Mechanisms in endocrinology: heart failure and
thyroid dysfunction. Eur J Endocrinol 2012;167:609–618.
- Shakoor SK, Aldibbiat A, Ingoe LE, et al: Endothelial
progenitor cells in subclinical hypothyroidism: the effect of
thyroid hormone replacement therapy. J Clin Endocrinol Metab
2010;95:319–322.
- Vanderpump MP, Tunbridge WM, French JM, et al: The
development of ischemic heart disease in relation to autoimmune
thyroid disease in a 20-year follow-up study of an English
community. Thyroid 1996;6:155– 160.
- Ochs N, Auer R, Bauer DC, et al: Meta-anal ysis: subclinical
thyroid dysfunction and the risk for coronary heart disease and
mortal ity. Ann Intern Med 2008;148:832–845.
- Rodondi N, den Elzen WP, Bauer DC, et al. Thyroid Studies
Collaboration: Subclinical hypothyroidism and the risk of
coronary heart disease and mortality. JAMA 2010;304:1365–1374.
- Jonklaas, J.; Bianco, A.C.; Bauer, A.J.; Burman, K.D.;
Cappola, A.R.; et al. Guidelines for the treatment of
hypothyroidism: Prepared by the american thyroid association
task force on thyroid hormone replacement. Thyroid
2014;24;1670–1751.
- Calissendor J, Falhammar H. To Treat or Not to Treat
Subclinical Hypothyroidism, What Is the Evidence? Medicina
2020;56:40. doi:10.3390/medicina56010040
- Stott D.J., Rodondi N., Kearney P.M., Ford I.,Westendorp
R.G.J. et al. Thyroid hormone therapy for older adults with
subclinical hypothyroidism. N. Engl. J. Med. 2017;376:2534–2544.
- Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H,Dosiou
C, et al. 2017 Guidelines of the American Thyroid Associationfor
the Diagnosis and Management of Thyroid Disease During Pregnancy
and the Postpartum.Thyroid. 2017;27(3):315-389.
- Brenda S. Bauer, Amaya Azcoaga-Lorenzo, Utkarsh Agrawal and
Colin McCowan. Management strategies for patients with
subclinical hypothyroidism: a protocol for an umbrella review.
Syst Rev 2021;10:290.
- Galina Khachikovna Safarian, Alexander Mkrtichevich Gzgzyan,
Kharryasovna Dzhemlikhanova Lyailya and Dariko Alexandrovna
Niauri. Does subclinical hypothyroidism and/or thyroid
autoimmunity influence the IVF/ICSI outcome? Review of the
literature. Gynecological Endocrinology. 2019;35(Sup1):56-59.
- Aguayo A, Grau G, Vela A, Aniel-Quiroga A, Espada M, Martul
P, Castano L, Rica IJ: Urinary iodine and thyroid function in a
population of healthy pregnant women in the North of Spain.
Trace Elem Med Biol 2013;27:302–306.
- Haddow JE, Palomaki GE, McClain MR: Thyroid-stimulating
hormone in singleton and twin pregnancy: importance of
gestational age-specific reference ranges. Obstet Gynecol
2006;107:205–206.
- Soldin OP, Soldin D, Sastoque M: Gestationspecific thyroxine
and thyroid stimulating hormone levels in the United States and
worldwide. Ther Drug Monit 2007;29:553–559.
- Haddow JE, McClain MR, Lambert-Messerlian G, Palomaki GE,
Canick JA, et al. First and Second Trimester Evaluation of Risk
for Fetal Aneuploidy Research Consortium: Variability in
thyroid-stimulating hormone suppression by human chorionic
gonadotropin during early pregnancy. J Clin Endocrinol Metab
2008;93:3341-3347.
- Kris Poppea, Peter Bisschopb Laura Fugazzolac, Gesthimani
Minziorid, David Unuanee Andrea Weghofer. 2021 European Thyroid
Association Guideline on Thyroid Disorders prior to and during
Assisted Reproduction. Eur Thyroid J. 2020;9:281–295.
- Vaidya B, Anthony S, Bilous M, Shields B, Drury J, Hutchison
S, et al. Detection of thyroid dysfunction in early pregnancy:
Universal screening or targeted high-risk case finding? J Clin
Endocrinol Metab. 2007;92(1):203–7.
- Brown RS: The thyroid; in Brook CGD, Clayton PE, Brown RS
(eds): Brook’s Clinical Pediatric Endocrinology, ed 6.
Chichester, Wiley-Blackwell, 2009; pp 250–282.
- Chaler EA, Fiorenzano R, Chilelli C, Llinares V, Areny G,
Herzovich Vet al.: Age-specific thyroid hormone and thyrotropin
reference intervals for a pediatric and adolescent population.
Clin Chem Lab Med 2012; 50: 885–890.
- King K, O’Gorman C, Gallagher S: Thyroid dysfunction in
children with Down syndrome: a literature review. Ir J Med Sci
2014;107:118–119.
- Ittermann T, Thamm M, Wallaschofski H, Rettig R, Volzke H:
Serum thyroid-stimulating hormone levels are associated with
blood pressure in children and adolescents. J Clin Endocrinol
Metab 2012; 97: 828–834.
- Aijaz NJ, Flaherty EM, Preston T, Bracken SS, Lane AH,
Wilson TA: Neurocognitive function in children with compensated
hypothyroidism: lack of short term effects on or off thyroxin.
BMC Endocr Disord 2006;6:2.
- Aleksić Ž, Aleksić A, Mitov V, Jolić A, Vešović D. Vrednosti
in vitro pokazatelja funkcijskog tiroidnog statusa kod
pacijenata na terapiji Amiodaronom. Medicinski glasnik Zlatibor.
2012;17(44 Suppl):90.
- Aleksić Ž, Aleksić A.. Incidenca amiodaronom indukovanih
tiroidnih disfunkcija i prediktivni faktori za njihov nastanak.
Timočki medicinski glasnik 2011;36(Suppl 1):28.
- Aleksić Ž, Aleksić A. Amiodaronom indukovan supklinički
hipotiroidizam. Timočki medicinski glasnik 2015;40(Suppl 1):31.
- Aleksić Ž, Aleksić A, Mitov V, Jolić A, Vešović D.
Amiodaronom indukovana tirotoksikoza kod prethodno subklinički
hipotiroidnog pacijenta na terapiji amiodaronom – prikaz
slučaja. Timočki medicinski glasnik 2012;37(Suppl 1):92.
- Aleksić Ž. Subklinički hipotiroidizam – dijagnostičke i
terapijske dileme. Timočki medicinski glasnik 2018;43(Suppl
1):38.
- Aleksić ŽP, Aleksić AZ, Mitov VM, Jolić AD, Vešović DM.
Amiodarone induced subclinical thyroid dysfunction – what to
expect during follow up? Is there reason for amiodarone
withdrawal? Eur Thyroid J 2012;1(suppl 1):188.
- Wu K, Zhou Y, Ke S, et al.Lifestyle is associated with
thyroid function in subclinical hypothyroidism: a
cross-sectional study. BMC Endocr. Disord. 2021;21:1–11.
- Zimmermann MB & Köhrle J. The impact of iron and selenium
deficiencies on iodine and thyroid metabolism: biochemistry and
relevance to public health. Thyroid 2002;12:867–878.
- Benvenga S, Nordio M, Laganà AS, et al.The Role of Inositol
in Thyroid Physiology and in Subclinical Hypothyroidism
Management. Front. Endocrinol. (Lausanne) 2021;12:458.
- Soliman AT, De Sanctis V, Yassin M, et al.Chronic anemia and
thyroid function. Acta Bio Medica Atenei Parm. 2017;88:119.
- Ventura M, Melo M & Carrilho F. Selenium and Thyroid
Disease: From Pathophysiology to Treatment. Int. J. Endocrinol.
2017:1297658. https://doi.org/10.1155/2017/1297658
|
|
|
|

