| |
|
|
UVOD
Skeletne metastaze su najčešći koštani tu-mori kod pacijenata
starijih od 40 godina [1, 2]. Kada dijagnostikujemo izolovanu
agresivnu leziju kosti, verovatnoća je 500 puta veća da je lezija
metastaza nekog primarnog malignog tumora, nego da je lezija
primarni maligni tumor kosti [3]. Ali, u 10% slučajeva primarni
tumor se ne dijagnostikuje [2, 4]. Najčešće metastaze u skeletu se
javljaju u kičmi, rebrima, proksimalnom femuru, lobanji,
proksimalnom humerusu itd. [2]. U 70% slučajeva metastaze se
javljaju u aksijalnom skeletu, odnosno kičmi, rebrima i karlici, a u
oko 30% u apendikularnom skeletu. Na autopsijama se objavljuju i
incidencije i do 70% postojanja skeletnih metastaza [5].
U Srbiji se godišnje javlja oko 32000 pacijenata sa raznim vrstama
malignih tumora [2]. Polovina od ovih pacijenata u nekom periodu
života razvija skeletne metastaze. U Srbiji maligni tumori, koji
najčešće daju metastaze i komplikacije u skeletu, su tumori
prostate, dojke, pluća, bubrega, štitne žlezde i melanom (tumor
melanocita) [2].
Samo u Velikoj Britaniji, godišnje preko 9000 slučajeva raka dojke
metastazira u skelet [6]. U Sjedinjenim Američkim Državama, godišnje
umre preko 500000 ljudi sa razvijenim skeletnim metastazama, prema
podacima Američke akademije ortopedskih hirurga.
Potrebno je znati da sve osteolitične ili osteoblastične lezije, u
bolesnika starijih od 40 godina, treba tretirati kao metastaze dok
se ne dokaže suprotno [1, 2, 3].
Prelom se razvija u 2 do 11% svih slučajeva skeletnih metastaza [1,
3, 6].
Klinička odluka o operativnom lečenju pacijenata sa skeletnim
metastazama i izbor operativne tehnike, najviše zavise od očekivane
dužine života. Da bi se smanjili rizici od reoperacije, treba da se
identifikuju pacijenti sa dugim preživljavanjem. Pacijenti sa dobrom
prognozom (solitarne metastaze bubrega i štitne žlezde) zahtevaju
široku resekciju i rekonstrukciju kosti kao primarni maligni tumori
[7, 8, 9, 10, 11]. Danas postoje različiti skoring sistemi koji
pomažu u odluci hirurga o operativnom lečenju i koji su zasnovani na
dužini preživljavanja, kao što su Bauerov skor, Katagiri skor,
Tomita skoring sistem, Capanna skoring, Tokuhashi skoring sistem,
Soitous skor, Van der Linden skor [12, 13, 14, 15, 16]. Obično se u
skoring sistemima u analizi ovog prognostičkog faktora pacijenti
dele u 2 ili 3 podgrupe, sa vrstama primarnog tumora umerenog
(prostata, dojka, štitna žlezda) ili brzog rasta (pluća, melanom,
kolorektalni karcinom, nepoznati primarni tumor itd) [12, 13, 14,
15, 16].
MATERIJAL I METODE
Ova studija je imala 32 pacijenta koji su imali hirurški tretman
koštanih metastaza dugih cevastih kostiju u Zdravstvenom centru
Sremska Mitrovica i IOH "Banjica" u Beogradu, u periodu od 2000. do
2009. godine. Primarni tumori svrstani su u dve grupe: karcinomi sa
rapidno brzim rastom i karcinomi sa umereno brzim rastom. Ova podela
je izvršena prema stepenu biološke agresivnosti i malignosti
primarnog tumora, pa su u karcinome sa rapidno brzim rastom svrstani
karcinom pluća, melanom, karcinom uterusa i karcinom nepo-znatog
porekla, a u grupu sa umereno brzim rastom karcinomi bubrega, dojke,
prostate i štitne žlezde [10, 11, 12, 13, 14]. Analizirano je
postoperativno preživljavanje ove dve podgrupe. U ovom radu
korišćene su sledeće statističke metode: osnovne deskriptivne i
analitičke statističke metode (T-test, Kaplan-Meier i Cox regresioni
model).
REZULTATI
Deskriptivne statističke metode
U grupi operisanih pacijenata, od ukupno 32 pacijenta, bilo je 18
žena i 14 muškaraca (56,4% žena i 43,6% muškaraca).
Godine života su bile od 43 do 78 godina, a srednje životno doba
operisanih pacijenata je bilo 61,9 godina.
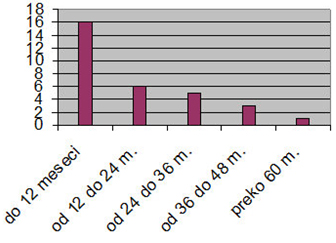
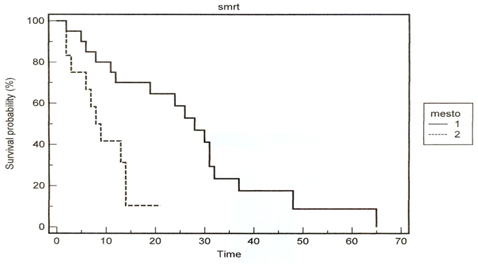
Grupa operisanih pacijenata imala je vreme praćenja od 2 do 65
meseci. Pacijenti su praćeni do smrti ili do kraja istraživanja.
Vreme preživljavanja operisanih pacijenata je bilo od 2 meseca do 65
meseci (grafikon 1).
Ukupna stopa preživljavanja grupe operisanih bolesnika 6 meseci bila
je 0,78, 12 meseci - 0,59, 16 meseci - 0,46, 24 meseca - 0,31, 36
meseci - 0,12, 48 meseci - 0,06 i 60 meseci - 0,03. Srednje
preživljavanje grupe sa karcinomima rapidno brzog rasta bilo je 8
meseci, a grupe sa umereno brzim rastom tumora 28 meseci.
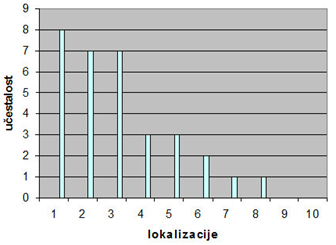
Primarni maligni tumori bili su:
- tumor pluća, 8 slučaja i to je 25% svih tumora,
- tumor bubrega, 7 ili 21,8%,
- tumor dojke, 7 ili 21,8 %,
- nepoznati primarni tumor, 3 ili 9,4%,
- melanom, 3 ili 9,4%,
- tumor prostate, 2 ili 6,2 %,
- tiroidea, 1 ili 3,1%,
- uterus, 1 ili 3,1 % (grafikon 2).
Skoro 10% skeletnih metastaza bilo je uzrokovano nepoznatim
primarnim malignim tumorom, a najviše operisanih metastaza dali su
karcinomi pluća, bubrega i dojke.
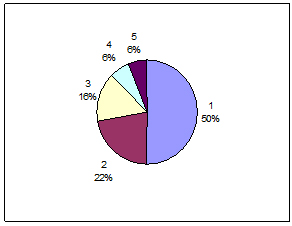
Pacijenti su bili operisani: metodom intralezionalne ekscizije, njih
16, amputacionom hirurgijom, njih 7, širokom resekcijom
(ekstralezionalna ekscizija) 5, metodom profilaktičke intramedularne
interloking fiksacije bez uklanjanja tumora, 2 slučaja, metodom
endoprotetske hirurgije kuka, 2 slučaja (grafikon3).
Grafikon 1. Vreme praćenja operisanih pacijenata
Garfikon 2. Lokalizacije primarnog tumora
(1. pluća, 2. bubreg, 3. dojka, 4. nepoznati primarni tumor, 5.
melanom, 6. prostata, 7. tiroidea, 8. uterus).
Grafikon 3. Vrste hirurške intervencije
(1. intralezionalna ekscizija, 2. amputacije,
3. ekstralezionalna ekscizija, 4. profilaktička intramedularna
fiksacija, 5. endoproteze kuka).
Analitičke statističke metode
Grupa operisanih podeljena je u podgrupe sa različitim biološkim
ponašanjem primarnog tumora, kao što je u većini svetskih skoring
sistema za predviđanje očekivane dužine života ovih pacijenata, na
umereno i brzorastuće tumore.
Stopa preživljavanja grupe operisanih bolesnika 6 meseci bila je
0,78, 12 meseci - 0,59, 16 meseci - 0,46, 24 meseca - 0,31, 36
meseci - 0,12, 48 meseci - 0,06 i 60 meseci - 0,03. Analizom
podataka utvđeno je da postoji statistički značajna razlika između
dužine preživljavanja pacijenata sa karcinomima umerenog rasta, u
odnosu na dužinu preživljavanja pacijenata sa karcinomima rapidno
brzog rasta. Srednje preživljavanje grupe sa karcinomima rapidno
brzog rasta bilo je 8 meseci, a grupe sa umereno brzim rastom tumora
28 meseci. Urađena je statistička obrada podataka T-testom i dobijen
je rezultat da je statistički značajna razlika u dužini
preživljavanja između ovih grupa p=0,002, p<0,01.
Kaplan-Meierovom metodom izračunato je da je 0,35 (35%) procenjena
proporcija rizika za smrt kod grupe sa umereno rastućim tumorima, u
odnosu na grupu sa rapidno rastućim tumorima (grafikon 4).
Podaci su obrađeni i Cox regresionim modelom proporcionalnih rizika
da bi se analizirala jačina uticaja primarnog tumora rapidnog rasta
na preživljavanje, a Cox regresioni faktor proporcionalnih rizika je
4,01 (grafikon 5).
Grafikon 4. Kaplan-Meierova kriva preživljavanja.
1. Spororastući tumori; 2. Brzorastući tumori; y osa – vreme
preživljavanja u mesecima.
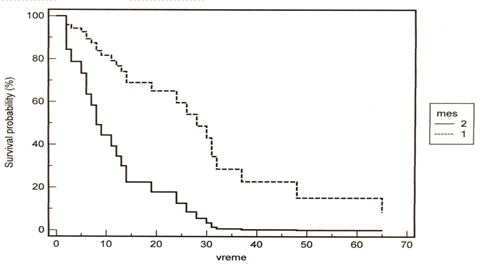
Grafikon 5. Cox regresioni model proporcionalnih rizika.
1. Spororastući tumori; 2. Brzorastući tumori; y osa – vreme
preživljavanja u mesecima.
DISKUSIJA
Stopa preživljavanja grupe operisanih bolesnika 6 meseci bila je
0,78, 12 meseci - 0,59, 16 meseci - 0,46, 24 meseca - 0,31, 36
meseci - 0,12, 48 meseci - 0,06 i 60 meseci - 0,03. I u ovoj seriji
je bilo relativno veliki broj tumora [16, 19] nepoznatog porekla,
9,4% [2, 4, 5, 6, 7, 11, 16, 17, 21]. Kod solitarne koštane
metastaze nastale od karcinoma bubrega i štitne žlezde, operativna
terapija je bila agresivna zbog očekivanog dugog preživljavanja [3,
8, 9, 11, 18, 20]. U našoj seriji imali smo najduže preživljavanje
od 65 meseci kod solitarne metastaze karcinoma bubrega. Operativna
terapija intralezionalne ekscizije ili kiretaže je bila
najzastupljenija kod naših ispitanika, i to 50% svih operacija
(slika 2). Hirurška rekonstrukcija je vršena koštanim cementom ili
protezama kuka (slika 4). Očekivana dužina života je veoma važna u
izboru rekonstrukcije postekscizionog defekta zbog čega je metod
izbora rekonstrukcije bio metilmetakrilat ili koštani cement, koji
daje trenutnu mobilnost ekstremiteta i oslonac na nogu. Najveći broj
autora smatra da očekivana dužina života mora biti za duge cevaste
kosti minimum 2 meseca, a za kičmu minimum 6 meseci [2, 3, 11, 18].
U ovom radu očekivana dužina života, kao preduslov hirurškoj
terapiji, bila je 2 meseca. Analizom T-testom je potvrđeno
statistički značajno duže preživljavanje podgrupe primarnih tumora
sa umereno brzim rastom (karcinomi bubrega, dojke, prostate i štitne
žlezde).
Primarni tumor je veoma snažan faktor za preživljavanje, sa
značajnom statističkom razlikom u preživljavanju dve grupe
ispitanika (T-testom je izračunat p od 0,002). Zatim, srednje
preživljavanje ovih pacijenata sa primarnim tumorom rapidnog rasta
je bio 8 meseci [7, 8, 10, 11, 12, 13, 14, 17]. Ovo je zbog toga što
ovoj grupi pripadaju tumori veoma agresivnog ponašanja i veoma
kratkog preživljavanja bolesnika, prema tome snažan negativan
prognostički faktor za preživljavanje je primarni tumor iz ove
grupe, a to je najčešće karcinom pluća [10, 11, 12, 19]. Danas
postoje različiti skoring sistemi, koji pomažu u odluci hirurga o
operativnom lečenju, zasnovani na dužini preživljavanja, kao što su
Bauerov skor, Katagiri skor, Tomita skoring sistem, Capanna skoring,
Tokuhashi skoring sistem, Soitous skor, Van der Linden skor [12, 13,
14, 15, 16, 17]. Kod njih je tip primarnog tumora jedan od
najvažnijih prognostičkih faktora. Ovi skoring sistemi pomažu u
postavljanju indikacija za operativno lečenje u zavisnosti od
očekivane dužine života pacijenata [10, 11, 12, 13, 14, 15, 16, 17,
18]. Pored ovog parametra, koriste se i drugi parametri koji se u
skoring sistemima vrednuju u numerički zbir koji pomaže u
postavljanju indikacija za operativno lečenje. Rezultati u ovoj
studiji su slični studijama Bauera, 2005. g, Malawera, 2001. g,
Toyoda, 2007. g, Fottnera, 2010, Nakashime, 2010 g, Wengnera, 2012.
godine.
Prilikom odabira terapije ovih pacijenata, treba voditi računa da je
preživljavanje ovih bolesnika sve duže, da primena bifosfonata
rapidno smanjuje stepen osteolize i time smanjuje destrukciju kosti
i čuva kvalitet kosti. Ovim bolesnicima je veoma važan kvalitet
preostalog života [3, 4, 6, 7].
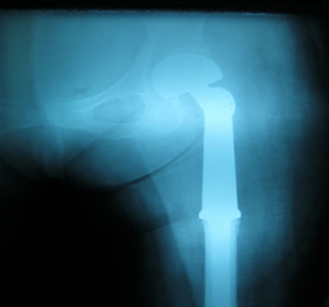
Slika1. Patoloski prelom femura – Ca. pluća.
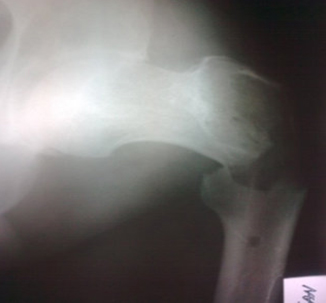
Slika 2. Postoperativni snimak femura (kiretaža+cementiranje
defekta+DCS).
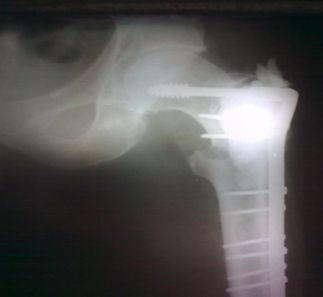
Slika 3. Patoloski prelom femura – Ca. dojke.
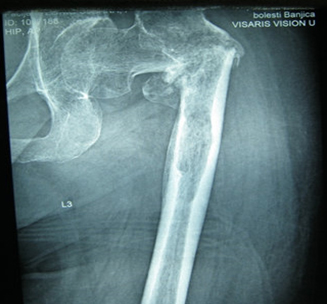
Slika 4. Postoperativni snimak
(resekcija lezije + tumorska proteza).
Kod primarnog tumora rapidnog rasta primenjuje se manje agresivna
hirurgija zbog manje očekivane dužine života, kao u slučajevima
nemikroceleularnih karcinoma pluća [11, 18, 19], melanoma, karcinoma
želuca ili tumora nepoznatog porekla [9, 10, 11, 18]. Kod podgrupe
tumora umerenog rasta (slika 3), primenjuje se dugovečna
rekonstrukcija postekcizionog defekta kosti, cementne standardne
proteze, tumorske proteze (slika 4), ili rekonstrukcioni klinovi.
Oni moraju da budu dugovečniji od preostalog života pacijenta [5,
11, 18, 19]. To je naročito teško kod solitarnih metastaza karcinoma
bubrega, dojke i štitne žlezde zbog mogućnosti veoma dugog
preživljavanja [6, 9, 10, 19]. Zbog toga je kod ove grupe pacijenata
indikovana agresivna ortopedska hirurgija sa širokom resekcijom
lezije po Ennekingu [6, 12, 16, 17, 20].
ZAKLJUČAK
Primarni tumor rapidnog rasta ili velike biološke agresivnosti je
snažan nezavisan negativan prognostički faktor preživljavanja. Ovaj
prognostički faktor je deo svih skoring sistema. U zavisnosti od
prognostičkog faktora primarnog tumora, indikuje se i vrsta
rekonstrukcije postekscizionog defekta kosti koštanim cementom,
osteosintetskim implantatima, parcijalnim, totalnim ili tumorskim
protezama kuka ili kolena. Na osnovu ovog rada, mogu se dati sledeće
preporuke:
- kod skeletnih metastaza poreklom od brzorastućih tumora (karcinom
pluća, melanom, karcinom želuca, karcinom jetre), treba
upotrebljavati manje invazivnu hirurgiju (parcijalne, standardne
cementne totalne proteze kuka, profilaktička intramed. fiksacija bez
uklanjanja tumora, osteosinteza sa uklanjanjem tumora i upotrebom
koštanog cementa (slika 1 i 2) [3, 9, 18, 19];
- kod skeletnih metastaza poreklom od spororastućih tumora (dojka,
bubreg, štitna žlezda, prostata), treba upotrebljavati invazivnu
hirurgiju (totalne proteze kuka ili kolena, totalne cementne proteze
sa dugim femoralnim stemom, tumorske parcijalne ili totalne cementne
proteze (slika 3 i 4), osteosinteze sa širokom ili marginalnom
ekscizijom tumora i upotrebom koštanog cementa, interkalarni spejser
[3, 5, 8, 9, 20]. Naravno, ako opšte stanje pacijenta to dozvoljava;
- dužina preživljavanja mehaničke konstrukcije implantata mora biti
duža od preostalog života ovih bolesnika [5, 11, 18].
LITERATURA
- Harrington KDE. Orthopaedic surgical management of skeletal
comlpications of malignancy. Cancer. 1997; Oct. 15; 80 (8 suppl
): 1614-27.
- Atanacković M. Sekundarni tumori kostiju. U: Patologija
kostiju i zglobova. Naučna knjiga; 1990; 159-163.
- Wedin R, Surgical treatment for pathological fracture. Acta
Orthop Scan (Suppl) 2001; 72: 1-29.
- Simon MA, Bartucci EJ. The search for the primary tumor in
patients with skeletal metastases of unknown origin. Cancer
1986; 58: 1088-1095.
- Wegener B, Schlemmer M, Stemmler J, et al. Analysis of
Orthopaedic Surgery of Bone Metastases in Breast Cancer
Patients, BMC Musculoskelet Disord. 2012; 13: 232.
- British Assotiation of Surgical Oncology Guidelines. The
management of metastaic bone disease in the United Kingdom. Eur
J Surg Oncol 1999; Feb; 25 (1): 3-23.
- Bauer HCF,Wedin R. Survival after surgery for spinal and
extremity metastases. Acta Orthop Scand. 1995; 66: 143-6.
- Malawer MM,Sugarbaker PH editors. Treatment of Metastaic
Bone Disease. In: Muskuloskeltal Cancer Surgery: Treatment of
sarcomas and Allied diseases.Boston: Kluwer Academic Publishers,
2001; 215-233.
- Fottner A, Szalantzy M, Wirthmann L et al. Bone metastases
from renal cell carcinoma: patient survival after surgical
teratment. BMC Musculoskeletal Disord. 2010; 3; 11: 145.
- Toyoda Y, Shinohara N, Harabayashi T, et al. Survival and
prognostic clasification of patients with metastatic renal cell
carcinoma of bone. Eur Urol. 2007; Jul; 52 (1): 163-8. Epub
2006. Nov 7.
- Capanna R, Campanacci D, The treatment of metastases in the
appendicular skeleton. J Bone Joint Surg [Br] 2001; 83-B:
471-81.
- Katagiri H, Takahashi M, Wakai K. et al. Prognostic factors
and a scoring system for patients with skeletal metastasis. J
Bone Joint Surg Br, 2005; 87-b, (5): 698-703.
- Teshima T, Chatani M, Inoue T, et al. Prognostic factors for
patients with osseus metastasis: a multiinstitutional
prospective study. Strahlenther Onkol 1990; 166: 387-91.
- Tokuhashi Y, Matsuzaki H, Toriyama S, Kawanao H, Ohsaka S.
Skoring system for the preoperative evaluation of meatastaic
spine tumor prognosis. Spine 1990; 15: 1110-13.
- Enneking WE. Staging of musculoskeletal tumors. In: Enneking
WE editor. Muskuloskeletal tumors surgery, Vol 1, New York,
Churchill Livingston; 1983; 87-8.
- Enneking WE, Spanier SS, Goodman MA. A system for the
surgical staging of Muskuloskeletal Bones. Clinical Orthop 1999;
358: 128-139. Sarcoma. Clin Orthop. 1980; 153: 106-120.
- Leithner A, Radl R, Gruber G, Hochegger M, at al. Predictive
value of seven preoperative prognostic scoring systems for
spinal metastases, Eur Spine J. 2008. Novemeber; 17 (11):
1488-1495.
- Nakashima H, Katagiri H, Takahashi M, Sugiura H. Survival
and ambulatory function after endoprosthetic replacement for
metastatic bone tumor of the proximal femur. Nagoya J Med Sci.
2010. Feb; 72 (1-2): 13-21.
- Decroisette C, Monnet I, Berard H et all. Epidemiology and
treatment costs of bone metastases from lung cancer: a French
prospective, observational, multicenter study (GFPC0601). J
Thorac Oncol. 2011. Mar; 6 (3): 576-82.
- Qingcheng Y, Bizeng Z, Zhichang Z, Yang D, Yao P, and Xinhui
D. Shortterm outcomes of en bloc resection of solitary bone
metastases in limbs. Med Sci Monit. 2012; 18 (11): CR648–CR655.
Published online Nov 1, 2012.
|
|
|
|









