| |
|
|
UVOD
Kardiovaskularne bolesti su vodeći uzrok smrti bolesnika koji se
leče ponavljanim hemodijalizama [1, 2]. Kod ovih bolesnika prisutni
su brojni faktori rizika (visok arterijski krvni pritisak, poremećaj
metabolizma lipida, oksidativni stres, mikroinflamacija,
hiperhomocisteinemija, anemija, povećan protok krvi kroz vaskularni
pristup za hemodijalizu, hipervolemija, sekundarni
hiperparatireoidizam) odgovorni za razvoj kardiovaskularnih
komplikacija [1–3]. Najčešće kardiovaskularne komplikacije kod
bolesnika koji se leče ponavljanim hemodijalizama su hipertrofija
leve komore, ishemijska bolest srca i srčana slabost [3–7].
Ishemija miokarda kod bolesnika na hemodijalizi
Bolesnici koji se leče ponavljanim hemodijalizama imaju povećan
rizik od ishemije miokarda usled smanjenog protoka krvi kroz
koronarne arterije u dijastoli (hipertrofija leve komore, povećana
krutost perifernih arterija), ateroskleroze i arterioskleroze
koronarnih arterija, ožiljavanja intersticijuma miokrada i bolesti
malih krvnih sudova intersticijuma miokarda [3–7]. Standardna
hemodijaliza, sama po sebi ima potencijal da podstiče/uzrokuje
ishemiju miokarda, a ishemijski događaji koji se ponavljaju
izazivaju ošamućenje miokarda, razvoj srčane slabosti i iznenadne
srčane smrti [3–7].
HEMODIJALIZA – FAKTOR RIZIKA ZA RAZVOJ KARDIOVASKULARNIH
KOMPLIKACIJA
Hemodijaliza je značajan faktor rizika za ponavljane epizode
ishemije miokarda (ošamućenje miokarda) i razvoj sistolne srčane
slabosti, ali i značajan faktor rizika, okidač za iznenadnu srčanu
smrt bolesnika (brza izmena elektrolita (Na+, Ca2+) i tečnosti u
toku seanse hemodijalize) [8–12]. Dva najznačajnija faktora rizika
za razvoj kardiomiopatije povezane sa hemodijalizom su
intradijalizna hipotenzija (hemodinamska nestabilnost) i visoka
stopa ultrafiltracije (sa ili bez hemodinamske nestabilnosti)
[8–12].
Intradijalizna hipotenzija
Intradijalizna hipotenzija se definiše kao smanjenje sistolnog
arterijskog krvnog pritiska za ≥20mmHg, ili smanjenje srednjeg
arterijskog krvnog pritiska za ≥10mmHg u toku seanse hemodijalize
8. Smanjenje arterijskog krvnog pritiska u toku hemodijalize je
praćeno simptomima, kao što su: muka, gađenje, povraćanje, grčevi u
mišićima, a kod bolesnika sa bolestima srca pad sistolnog
arterijskog krvnog pritiska može da podstakne srčane aritmije,
akutni ishemijski koronarni i/ili cerebralni događaj (simptomatska
intradijalizna hipotenzija) [8].
Epidemiološki podaci pokazuju da je intradijalizna hipotenzija
faktor rizika za razvoj kardiovaskularnog morbiditeta i mortaliteta
i da njena prevalencija iznosi 20–30% ukupnog broja seansi
hemodijaliza [8–12]. Povećan rizik od razvoja intradijalizne
hipotenzije imaju bolesnici koji boluju od dijabetesne nefropatije,
bolesnici sa kardiovaskularnim poremećajima (hipertrofija leve
komore, poremećaj dijastolne funkcije leve komore, poremećaj
sistolne funkcije leve komore, bolest perifernih arterija),
bolesnici sa lošim nitritivnim statusom (hipoalbuminemija), sa
poremećajem autonomnog nervnog sistema (dijabetesna/ uremijska
polineuropatija), bolesnici sa visokim interdijaliznim prinosom i
velikom stopom ultrafiltracije, kao i bolesnici sa predijaliznim
sistolnim krvnim pritiskom manjim od 100mmHg [8–12].
Patogeneza intradijalizne hipotenzije je višefaktorska, uključuje
faktore povezane sa procedurom hemodijalize (stopa ultrafiltracije,
temperatura rastvora za hemodijalizu, koncentracija natrijuma i
kalcijuma u rastvoru za hemodijalizu) i faktore povezane sa
bolesnikom (kardiovaskularne bolesti: hipertrofija leve komore,
poremećaj sistolne i dijastolne funkcije leve komore, srčane
aritmije, poremećaj funkcije endotelnih ćelija, sindrom ishemije
miokarda, bolesti perikarda, poremećaj funkcije autonomnog nervnog
sistema) [8–12]. Tri najznačajnija faktora za razvoj intradijalizne
hipotenzije su: hipertrofija leve komore (70–80% bolesnika koji se
leče hemodijalizom), značajno smanjenje efektivnog cirkulišućeg
volumena krvi/relativnog volumena krvi (velika stopa
ultrafiltracije, neadekvatna „suva” telesna masa bolesnika) i
poremećaj funkcije autonomnog nervnog sistema [8–12]. Najčešće se
radi o kombinaciji velike stope ultrafiltracije (prevaziđen
kapacitet obnavljana volumena u vaskularnom odeljku) i poremećaja
funkcije autonomnog nervnog sistema (smanjen tonus perifernih
arterija) [8–12].
Akutna hipotenzija u toku hemodijalize može da ima za posledicu
akutni ishemijski koronarni i/ili cerebralni događaj, kao i nastanak
poremećaja srčanog ritma, dok ponavljane epizode intradijalizne
hipotenzije dovode do ošamućenja miokarda, razvoja sistolne srčane
slabosti, komorskih poremećaja srčanog ritma i iznenadne srčane
smrti [8–12].
Velika stopa ultrafiltracije u toku hemodijalize
Velika stopa ultrafiltracije u toku hemodijalize je faktor rizika za
razvoj kardiovaskularnih komplikacija u ovoj populaciji bolesnika.
Dva glavna klinička stanja koja zahtevaju veliku stopu
ultrafiltracije su: povećan interdijalizni prinos u telesnoj masi
bolesnika (nepoštovanje higijensko-dijetetskog režima, odsustvo
motivacije i edukacije bolesnika) i neadekvatno procenjena „suva”
telesna masa bolesnika [13, 14]. Bolesnici koji se leče ponavljanim
hemodijalizama, sa povećanim interdijaliznim prinosom u telesnoj
masi, imaju povećan rizik od intradijalizne hipotenzije i srčane
smrti [13, 14]. Visoka stopa ultrafiltracije za posledicu ima
nesklad između odstranjivanja i obnavljanja zapremine krvi u
intravaskularnom odeljku [posebno kod bolesnika sa poremećajem
funkcije autonomnog nervnog sistema (uremijska/dijabetesna
polineuropatija)], razvoj intradijalizne hipotenzije, ishemije i
reperfuzije miokarda (ošamućenje miokarda) [13, 14]. Rezultati
kliničkih ispitivanja pokazuju da bolesnici sa stopom
ultrafiltracije >10ml/kg/h imaju značajno veći rizik od opšte i
srčane smrtnosti u odnosu na bolesnike sa stopom ultrafiltracije
≤10ml/kg/h [14, 15].
Dva glavna terapijska postupka za smanjenje stope ultrafiltracije u
kliničkoj praksi su: ograničen unos soli i tečnosti
(higijensko-dijetetski režim, motivacija i edukacija bolesnika) i
produženo vreme odstranjivanja tečnosti (produženo trajanje
pojedinačne seanse hemodijalize) [14, 15].
KLINIČKE POSLEDICE PONAVLJANIH EPIZODA ISHEMIJE/REPERFUZIJE
MIOKARDA
Standardna hemodijaliza (3 x nedeljno po 4h) izaziva hemodinamski
stres i dovodi do razvoja intradijalizne hipotenzije (smanjen protok
krvi kroz miokard, ishemija miokarda u toku hemodijalize) [16–20].
Hemodinamski stres izazvan hemodijalizom dovodi do akutnog
reverzibilnog smanjenja protoka krvi u miokardu i reverzibilnog
poremećaja segmentne kontraktilnosti leve komore (ošamućenje
miokarda) [20]. Velika stopa ultrafiltracije i/ili intradijalizna
hipotenzija za posledicu imaju hipoperfuziju i ishemiju miokarda.
Epizode ishemije i reperfuzije miokarda koje se ponavljaju, dovode
do ošamućenja miokarda, a ošamućenje miokarda je glavni okidač
razvoja sistolne srčane slabosti [16–20]. Dve najznačajnije
kategorije faktora za razvoj ošamućenja miokarda kod bolesnika koji
se leče ponavljanim hemodijalizama su: metabolički/ćelijski faktori
(smanjen nivo ATP-a, oštećena oksidativna fosforilacija) i
vaskularni faktori (poremećaj funkcije endotela, mikrovaskularna
disfunkcija, smanjena rezerva koronarnog protoka) [16–20]. Ovi
faktori dovode do poremećaja homeostaze kalcijuma, viška kalcijuma u
kardiomiocitima, aktivacije proteaza zavisnih od kalcijuma,
povećanog oksidativnog stresa i inflamacije, a sve to uz regionalnu
ishemiju miokarda za posledicu ima ošamućenje miokarda [16–20].
Tokom vremena dolazi do poremećaja (smanjene) regionalne
pokretljivosti zida leve komore (RWMA), nepovratnih ožiljnih promena
u intersticijumu miokarda, sistolne srčane slabosti, aritmija i
iznenadne srčane smrti [18–22]. Posle 12 meseci praćenja bolesnika,
pokazano je da bolesnici koji su imali poremećaj regionalne
pokretljivosti zida leve komore (RWMA grupa) imaju statistički
značajno manju ejekcionu frakciju leve komore i povećan rizik od
nepovoljnog ishoda, u odnosu na bolesnike koji nisu imali dokazan
poremećaj regionalne pokretljivosti zida leve komore [18–23]. Osećaj
gušenja, malaksalost, zamaranje i smanjena tolerancija fizičkog
opterećenja negativno utiču na kvalitet života bolesnika koji se
leče ponavljanim hemodijalizama [21–23].
OTKRIVANJE VISOKO RIZIČNIH BOLESNIKA
Otkrivanje bolesnika sa povećanim rizikom od hemodinamske
nestabilnosti u toku hemodijalize
Povećan rizik od razvoja hemodinamske nestabilnosti (intradijalizne
hipotenzije) u toku seanse hemodijalize imaju bolesnici sa velikim
interdijaliznim prinosom u telesnoj masi – IDWG > 5%, sa visokom
stopom ultrafiltracije >10ml/kg/h, bolesnici sa izmenjenom
morfologijom i funkcijom leve komore (hipertrofija leve komore,
poremećaj dijastolne i sistolne funkcije leve komore), kao i
bolesnici sa poremećajem funkcije autonomnog sistema (smanjena
promenljivost frekvencije srčanog rada, smanjena osetljivost
baroreceptora, smanjen periferni presorni odgovor/odsustvo povećanja
perifernog vaskularnog otpora) [24,25]. Osetljivost baroreceptora je
značajna za autonomnu kratkoročnu kontrolu arterijskog krvnog
pritiska. Smanjena osetljivost baroreceptora (smanjen odgovor
barorefleksnog luka – BRS odgovor) i nepotpun periferni presorni
odgovor (smanjen simpatički odgovor ili odgovor periferne vaskularne
rezistencije – TPR odgovor) su prediktori razvoja intradijalizne
hipotenzije i hemodinamske nestabilnosti bolesnika u toku seanse
hemodijalize [24,25].
Kvantitativna procena funkcije autonomnog nervnog sistema (BRS
odgovor, TPR odgovor) i ehokardiografska procena građe i funkcije
leve komore (težak poremećaj dijastolne funkcije ili poremećaj
restrikcije) pružaju mogućnost izdvajanja bolesnika koji imaju
povećan rizik od razvoja intradijalizne hipotenzije i hemodinamske
nestabilnosti u toku seanse hemodijalize (podobni da razviju
intradijaliznu hipotenziju) [7,24,25].
Otkrivanje bolesnika sa povećanim rizikom od ošamućenja miokarda i
razvoja srčane slabosti
Izdvajanje bolesnika koji imaju povećan rizik od ošamućenja miokarda
i poremećaja regionalne pokretljivosti zida leve komore omogućava
pravovremenu primenu odgovarajućeg plana lečenja za sprečavanje
razvoja sistolne srčane slabosti i iznenadne srčane smrti u ovoj
populaciji bolesnika, shema 1 [20-23]. Kod bolesnika koji imaju
prolazne, reverzibilne epizode intradijalizne hipotenzije, kao i kod
bolesnika sa velikom stopom ultrafiltracije (u odsustvu čestih
epizoda intradijalizne hipotenzije), potrebno je uraditi ultrazvučni
pregled srca ili pozitron emisionu tomografiju srca (H215O PET sken
srca) u toku seanse hemodijalize (0h, 2h, 4h). Ovi pregledi pokazuju
da je ošamućenje miokarda izazvano hemodijalizom prisutno kod
približno 60% bolesnika [20-23]. Pozitron emisiona tomografija srca
(H215O PET sken) u toku seanse hemodijalize pokazuje da su poremećaj
regionalne pokretljivosti zida leve komore – RWMA, i segmentni
poremećaj funkcije leve komore (segmentno smanjenje frakcionog
skraćenja za >20% u odnosu na početnu vrednost), posledica smanjenog
regionalnog protoka krvi kroz miokard (angiografski pregled je
prethodno isključio značajnu koronarnu arterijsku bolest) [20-23].
Do smanjenja regionalne pokretljivosti zida leve komore dolazi u
onim regionima miokarda gde je smanjenje protoka krvi ≥30%, u odnosu
na početni protok krvi (predijalizni protok krvi kroz miokard)
[20-23]. Ispitivanja pokazuju značajnu povezanost između regionalne
pokretljivosti leve komore i koncentracije srčanog troponina T u
serumu. Srčani troponin T se može koristiti za izdvajanje bolesnika
koji imaju povećan rizik od ošamućenja miokarda [20-23,26].
Koncentracija troponina T u serumu pre dijalize >0,6ng/ml može da
ukaže na povećan rizik od razvoja ošamućenja miokarda u toku seanse
hemodijalize [26]. Pozitron emisiona tomografija srca je zlatni
standard za procenu perfuzije miokarda. Korišćenje H215O (kratak
poluživot) pruža mogućnost serijskog merenja protoka krvi u kratkim
vremenskim intervalima u toku seanse hemodijalize. Kod bolesnika kod
kojih se dokaže poremećaj perfuzije miokarda i poremećaj regionalne
pokretljivosti zida leve komore (RWMA), neophodno je što pre
obezbediti hemodinamsku stabilnost u toku seanse hemodijalize i
sprečiti razvoj intradijalizne hipotenzije (promena preskripcije
hemodijalize, hemodijafiltracija, biofeedback hemodijaliza-BFD)
[20-23].
Shema 1. Algoritam za otkrivanje i lečenje
bolesnika
sa poremećajem funkcije srca kod bolesnika koji se leče
hemodijalizom.
Figure 1. Algorithm for evaluating and managing
symptomatic cardiac dysfunction in hemodialysis patients.
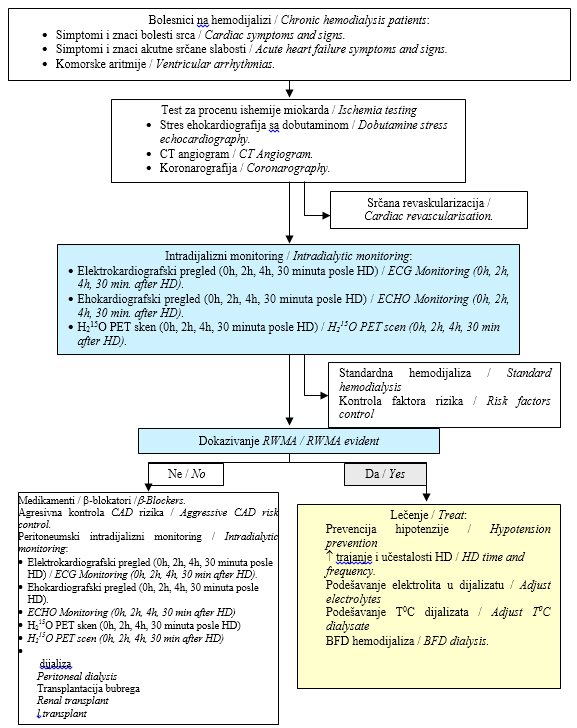
Modifikovano prema Dorairajan i sar. [20].
Modifed according to Dorairajan et al. [20].
Otkrivanje bolesnika sa povećanim rizikom od iznenadne srčane
smrti
Plan za otkrivanje bolesnika sa povećanim rizikom od iznenadne
srčane smrti treba da uključi: kliničku procenu bolesnika (anamneza,
fizikalni pregled bolesnika), standardni ehokardiografski pregled
(procena građe i funkcije leve komore), ehokardiografski pregled u
toku hemodijalize (poremećaj regionalne pokretljivosti zida leve
komore), standardni elektrokardiografski pregled (merenje trajanja
QT/QTc intervala, merenje disperzije QTc intervala, promenljivost
amplitude i dužine trajanja T talasa), merenje promenljivosti
frekvencije srčanog rada (HRV), merenje osetljivosti baroreceptora,
određivanje koncentracije srčanih troponina (troponin T, troponin I)
[27–31]. Kod bolesnika koji se leče ponavljanim hemodijalizama,
QTc>500ms i dQTc>50ms ukazuju na visok rizik od komorskih poremećaja
srčanog ritma i iznenadne srčane smrti [27–32].
PLAN LEČENJA ISHEMIJE MIOKARDA NASTALE USLED HEMODINAMSKE
NESTABILNOSTI U TOKU HEMODIJALIZE
Postupci za sprečavanje razvoja intradijalizne hipotenzije
(ishemija/reperfuzija miokarda) uključuju nefarmakološke i
farmakološke mere [33]. U nefarmakološke mere spadaju
higijensko-dijetetski režim (restrikcija unosa natrijuma na 2–3g,
odnosno 90–100mmol/24h), motivacija i edukacija bolesnika (sprečiti
veliki interdijalizni prinos u telesnoj masi, isključiti potrebu za
velikom stopom ultrafiltracije u toku seanse hemodijalize) [33].
Pored higijensko-dijetetskog režima, potrebna je i individualizacija
dijalizne preskripcije: podešavanje koncentracije natrijuma u
dijalizatu (Na+D140mmol/l), podešavanje koncentracije kalcijuma u
dijalizatu (Ca2+D≥1,75mmol/l), podešavanje temperature rastvora za
hemodijalizu (T 35–36ºC – hladan rastvor za hemodijalizu), optimalna
ultrafiltracija (UF≤10ml/kg/h), optimalna doza pojedinačne seanse
hemodijalize (Kt/V≥1,2) [33,38].
Povećana učestalost i produženo trajanje pojedinačne seanse
hemodijalize mogu da smanje rizik od intradijalizne hipotenzije i
poprave hemodinamsku stabilnost, ali je to u kliničkoj praksi
dostupno malom broju bolesnika. Noćna hemodijaliza (6 x 8h/nedeljno)
popravlja osetljivost baroreceptora, obezbeđuje bolju hemodinamsku
stabilnost, smanjuje rizik od ošamućenja miokarda i pruža bolje
preživljavanje bolesnika, u odnosu na standardnu hemodijalizu (3 x
4h/nedeljno) [34]. Napredak u tehnologiji aparata/mašina za
hemodijalizu omogućio je razvoj modula za procenu relativnog
volumena krvi (BVM sistem) i automatsko prilagođavanje stepena
ultrafiltracije i koncentracije natrijuma u dijalizatu (biofeedback
sistemi), u cilju održavanja intravaskularnog volumena i sprečavanja
razvoja intradijalizne hipotenzije (BFD hemodijaliza) [35-37].
Biofeedback sistemi automatski kontrolišu krvni pritisak i
hemodinamsku stabilnost bolesnika u toku seanse hemodijalize.
U kliničkoj praksi postoje dva biofeedback sistema za optimalnu
kontrolu hemodinamske stabilnosti bolesnika u toku seanse
hemodijalize: Hemocontrol Biofeedback System (HBS sistem) i Blood
Volume Monitor (BVM sistem) [35-37]. HBS sistem smanjuje stopu
ultrafiltracije i povećava konduktivnost dijalizata (koncentraciju
Na+ u dijalizatu), istovremeno u toku seanse hemodijalize, kao
odgovor na smanjenje relativnog volumena krvi [35-37]. BVM sistem
automatski smanjuje stopu ultrafiltracije u slučaju smanjenja
volumena krvi u toku seanse hemodijalize. Klinička ispitivanja su
pokazala da pomenuti biofeedback sistemi smanjuju poremećaj
regionalne pokretljivosti zida leve komore-RWMA u odnosu na
standardnu hemodijalizu, kao i incidenciju intradijalizne
hipotenzije za 30%. S obzirom na višefaktorsku patogenezu,
povezanost između volumena krvi i intradijalizne hipotenzije nije
linearna, pa nije bilo moguće definisati vrednost volumena krvi koji
se smatra kritičnim za razvoj intradijalizne hipotenzije (apsolutni
prag), a takođe nije jasno definisan ni povećani rizik od pozitivnog
balansa natrijuma i povećanja prinosa u telesnoj masi bolesnika u
interdijaliznom periodu (HBS sistem) [35-37].
Podešavanje koncentracije natrijuma u dijalizatu se koristi za
stabilizaciju arterijskog krvnog pritiska i zahteva oprez zbog
rizika od pozitivnog balansa natrijuma i povećanja interdijaliznog
prinosa u telesnoj masi bolesnika. Linearno smanjenje koncentracije
natrijuma u rastvoru za hemodijalizu (148–131mmol/l), uz linearno
smanjenje stope ultrafiltracije, obezbeđuju dobru hemodinamsku
stabilnost bolesnika u toku seanse hemodijalize [35-37].
U toku seanse standardne hemodijalize (temperatura rastvora za
hemodijalizu iznosi 37ºC), kod većine bolesnika dolazi do porasta
telesne temperature i vazodilatacije, što može da utiče na njihovu
hemodinamsku stabilnost. Hladan rastvor za hemodijalizu (35ºC)
smanjuje broj epizoda intradijalizne hipotenzije, popravlja
vazoregulaciju (povećava osetljivost baroreceptora – BRS odgovor,
povećava perifernu vaskularnu rezistenciju – TPR odgovor) i
obezbeđuje hemodinamsku stabilnost bolesnika (hladan dijalizat
održava srednji arterijski krvni pritisak, čuva sistolnu i
dijastolnu funkciju leve komore kod bolesnika koji se leče
ponavljanim hemodijalizama) [38]. U kliničkoj praksi podešavanje
temperature dijalizata vrši se pomoću BTM sistema (Blood Temperature
Monitor biofeedback sistem), koji je u vidu odgovarajućeg modula
ugrađen u mašine za hemodijalizu [33-35]. Kod bolesnika sklonih
intradijaliznoj hipotenziji, BTM smanjuje incidenciju epizoda
hipotenzije za 50% [35-37]. Međutim, višefaktorska patogeneza
hipotenzije u toku seanse hemodijalize umanjuje korist od
biofeedback sistema [35-38].
Farmakološki terapijski postupci uključuju primenu karnitina u
obliku i.v. infuzije, u dozi od 20mg/kg u toku hemodijalize i
primenu midodrina (midodrine) per os, u dozi od mg, 30 minuta pre
hemodijalize [33].
Hemodinamska stabilnost u toku hemodijalize sprečava razvoj
ošamućenja miokarda, poremećaj regionalne prokrvljenosti i
pokretljivosti zida leve komore – RWMA (Regional Wall Motion
Abnormalities) i razvoj sistolne srčane slabosti [39,40].
ZAKLJUČAK
Rano izdvajanje bolesnika koji imaju visok rizik od
ishemije/reperfuzije miokarda u toku hemodijalize i pravovremena
primena odgovarajućeg lečenja za posledicu imaju sprečavanje razvoja
sistolne srčane slabosti, komorskih poremećaja srčanog ritma i
iznenadne srčane smrti bolesnika koji se leče ponavljanim
hemodijalizama. Hemodinamska stabilnost bolesnika u toku
hemodijalize treba da bude jedan od primarnih ciljeva nefrologa u
jedinicama za hemodijalizu.
LITERATURA
- Parfrey PS. Cardiac disease in dialysis patients: diagnosis,
burden of disease, prognosis, risk factors and management.
Nephrol Dial Transplant 2000; 15 (Suppl 5): 58–68.
- Petrović D, Obrenović R, Trbojević-Stanković J, Majkić-Singh
N, Stojimirović B. Cardiovascular mortality in hemodialysis
patients: clinical and epidemiological analysis. J Med Biochem
2011; 30 (4): 302–8.
- Petrović D, Jagić N, Miloradović V, Stojimirović B.
Non-tradicional risk factors for development of cardiovascular
complications in haemodialysis patients. Ser J Exp Clin Res
2009; 10 (3): 95–102.
- Petrović D, Miloradović V, Poskurica M, Stojimirović B.
Dijagnostika i lečenje ishemijske bolesti srca kod bolesnika na
hemodijalizi. Vojnosanit Pregl 2009; 66 (11): 897–903.
- Petrović D, Jagić N, Miloradović V, Nikolić A, Stojimirović
B. Diagnostics and therapy of left ventricular hypertrophy in
hemodialysis patients. Ser J Exp Clin Res 2011; 12 (1): 37–40.
- Petrović D, Miloradović V, Poskurica M, Stojimirović B.
Slabost srca bolesnika na hemodijalizi: procena i lečenje. Srp
Arh Celok Lek 2011; 139 (3–4): 248–55.
- Nedeljković B, Miloradović V, Radovanović M, Nikolić A,
Poskurica M, Petrović D. Dijastolna srčana slabost kod bolesnika
na hemodijalizi: etiopatogeneza, dijagnostika i lečenje. Med Čas
2014; 48 (1): 21–7.
- KDOQI Clinical Practice Guidelines for Cardiovascular
Disease in Dialysis Patients. Am J Kidney Dis 2005; 45 (4 Suppl
3): 16–153.
- Perazella MA. Approach to Patients with Intradialytic
Hypotension: A Focus on Therapeutic Options. Semin Dial 1999; 12
(3): 175–81.
- Santoro A. Cardiovascular dialysis instability and
convective therapies. Hemodialysis Int 2006; 10 (Suppl 1): 51–5.
- Rubinger D, Backenroth R, Sapoznikov D. Sympathetic Nervous
System Function and Dysfunction in Chronic Hemodialysis
Patients. Semin Dial 2013; 26 (3): 333–43.
12. Lewicki MC, Kerr PG, Polkinghorne KR. Blood Pressure and
Blood Volume: Acute and
- Chronic Considerations in Hemodialysis. Semin Dial 2013; 26
(1): 62–72.
- Davenport A. Can Advances in Hemodialysis Machine Technology
Prevent Intradialytic Hypotension? Semin Dial 2009; 22 (3):
231–6.
- Flythe JE, Brunelli SM. The Risk of High Ultrafiltration
Rate in Chronic Hemodialysis: Implications for Patients Care.
Semin Dial 2011; 24 (3): 259–65.
- Flythe JE, Kimmel SE, Brunelli SM. Rapid fluid removal
during dialysis is associated with cardiovascular morbidity and
mortality. Kidney Int 2011; 79 (2): 250–7.
- Selby NM, McIntyre CW. The Acute Cardiac Effects of
Dialysis. Semin Dial 2007; 20 (3): 220–8.
- McIntyre CV. Effect of hemodialysis on cardiac function.
Kidney Int 2009; 76 (4): 371–5.
- McIntyre CW. Haemodialysis-Induced Myocardial Stunning in
Chronic Kidney Disease - A New Aspect of Cardiovascular Disease.
Blood Purif 2010; 29 (2): 105–11.
- Zuidema MY, Dellspreger KC. Myocardial Stunning with
Hemodialysis: Clinical Challenges of the Cardiorenal Patient.
Cardiorenal Med 2012; 2 (2): 125–33.
- Dorairajan S, Chockalingam A, Misra M. Myocardial stunning
in hemodialysis: What is the overall message? Hemodialysis Int
2010; 14 (4): 447–50.
- McIntyre CW, Odudu A. Hemodialysis-Associated
Cardiomyopathy: A NewlyDefined Disease Entity. Semin Nephrol
2014; 27 (2): 87–97.
- McIntyre CW, Burton JO, Selby NM, Leccisotti L, Korsheed S,
Baker CSR, et al. Hemodialysis-Induced Cardiac Dysfunction Is
Associated with an Acute Reduction in Global and Segmental
Myocardial Blood Flow. Clin J Am Soc Nephrol 2008; 3 (1): 19–26.
- Burton JO, Jefferies HJ, Selby NM, McIntyre CW.
Hemodialysis-Induced Cardiac Injury: Determinants and Associated
Outcomes. Clin J Am Soc Nephrol 2009; 4 (5): 914–20.
- Rubinger D, Backenroth R, Sapoznikov D. Sympathetic Nervous
System Function and Dysfunction in Chronic Hemodialysis
Patients. Semin Dial 2013; 26 (3): 333–43.
- Chesterton LJ, Selby NM, Burton JO, Fialova J, Chan C,
McIntyre CW. Categorization of the hemodynamic response to
hemodialysis: The importance of baroreflex sensitivity.
Hemodialysis Int 2010; 14 (1): 18–28.
- Breidtardt T, Burton JO, Odudu A, Eldehni MT, Jefferies HJ,
McIntyre CW. Troponin T for the Detection of Dialysis-Induced
Myocardial Stunning in Hemodialysis Patients. Clin J Am Soc
Nephrol 2012; 7 (8): 1285–92.
- Kanabay M, Afsar B, Goldsmith D, Covic A. Sudden Death in
Hemodialysis: An Update. Blood Purif 2010; 30 (2): 135–45.
- Saravanan P, Davidson NC. Risk Assessment for Sudden Cardiac
Death in Dialysis Patients. Circ Arrhythm Electrophysiol 2010; 3
(5): 553–9.
- Petrović D, Stojimirović B. Cardiac troponins: outcome
predictors in hemodialysis patients. J Artif Organs 2009; 12(4):
258-63.
- Green D, Roberts PR, New DI, Kalra PA. Sudden Cardiac Death
in Hemodialysis Patients: An In-Depth Review. Am J Kidney Dis
2011; 57 (6): 921–9.
- Kanbay M, Solak Y, Covic A, Goldsmith D. Sudden Cardiac
Death in Patients with Chronic Kidney Disease: Prevention Is the
sine qua non. Kidney Blood Press Res 2011; 34 (4): 269–76.
- Petrović D, Trbojević-Stanković J, Stojanović-Marjanović V,
Nikolić A, Miloradović V. Iznenadna srčana smrt bolesnika na
hemodijalizi: procena rizika i prevencija. Ser J Exp Clin Res
2013; 14 (1): 29–32.
- Palmer BF, Henrich WL. Recent Advances in the Prevention and
Management of Intradialytic Hypotension. J Am Soc Nephrol 2008;
19 (1): 8–11.
- Jefferies HJ, Virk B, Schiller B, Moran J, McIntyre CW.
Frequent Hemodialysis Schedules Are Associated with Reduced
Levels of Dialysis-induced Cardiac Injury (Myocardial Stunning).
Clin J Am Soc Nephrol 2011; 6 (6): 1326–32.
- Donauer J. Hemodialysis-Induced Hypotension: Impact of
Technologic Advances. Semin Dial 2004; 17 (5): 333–5.
- Selby NM, Lambie SH, Camici PG, Baker CS, McIntyre CW.
Occurence of regional left ventricular dysfunction in patients
undergoing standard and biofeedback dialysis. Am J Kidney Dis
2006; 47 (5): 830–41.
- Davenport A. Using dialysis machine technology to reduce
intradialytic hypotension. Hemodialysis Int 2011; 15 (Suppl 1):
37–42.
- Chesterton LJ, Selby NM, Burton JO, McIntyre CW. Cool
dialysate reduces asymptomatic intradialytic hypotension and
increases baroreflex variability. Hemodialysis Int 2009; 13 (2):
189–96.
- Breidthardt T, McIntyre CW. Dialysis-Induced Myocardial
Stunning: The Other Side of the Cardiorenal Syndrome. Rev
Cardiovaasc Med 2011; 12 (1): 13–20.
- Selby NM, McIntyre CW. Protecting the Heart in Dialysis
Patients – Intra-Dialytic Issue. Semin Dial 2014; 27 (4): 332–5
Zahvalnost:
Autori zahvaljuju Ministarstvu prosvete, nauke i tehnološkog razvoja
Republike Srbije za projekat N0175014, čija su sredstva korišćena
kao jedan od izvora za finansijsku podršku ovog stručnog rada. |
|
|
|

