| |
|
|
UVOD
Iznenadna srčana smrt (sudden cardiac death - SCD) definiše se kao
smrt koja se događa u toku jednog sata od početka simptoma. Kod
bolesnika na hemodijalizi, hiperkaliemija, opterećenje volu-menom,
metabolička acidoza i sekundarni hiperparatireoidizam mogu biti
okidači stvaranja ektopičnih srčanih impulsa i dovesti do iznenadne
srčane smrti, shema 1 [1]. EPIDEMIOLOGIJA IZNENADNE SRČANE SMRTI
Bolesnici koji se leče hemodijalizom imaju visoku stopu smrtnosti.
Stopa smrtnosti bolesnika koji se leče hemodijalizom u 2004. godini
u Sjedinjenim Američkim Državama iznosila je 230/1000 bolesnika
godišnje (23%) [2-4]. Bolesti srca su glavni uzrok smrti i odgovorne
su za približno 45% svih smrtnih ishoda ovih bolesnika [2-4]. Od
svih uzroka srčane smrti, iznenadna srčana smrt čini
~60% [1].
Jednogodišnja stopa iznenadne srčane smrti bolesnika koji se leče hemodijalizom u Sjedinjenim Američkim Državama iznosi 5-7%
[2-4].
ETIOLOGIJA IZNENADNE SRČANE SMRTI
Bolesnici koji se leče hemodijalizom podložni su nastanku iznenadne
srčane smrti. Rezultati kliničke studije HEMO ukazuju da je
koronarna arterijska bolest najznačajniji pojedinačni faktor rizika
za nastanak iznenadne srčane smrti kod bolesnika koji se leče
hemodijalizom [3]. Pored ishemije (opstruktivna koronarna
arterijska bolest), i drugi poremećaji doprinose nastanku iznenadne
srčane smrti (srčana smrt povezana sa aritmijom), kao što su:
hipertrofija leve komore i fibroza intersticijuma miokarda
(smanjena tolerancija miokarda na ishemiju), brze izmene elektrolita
u toku pojedinačne hemodijalize (odsustvo kalijuma u rastvoru za
hemodijalizu) i poremećaj funkcije autonomnog nervnog sistema
(autonomna disfunkcija), shema 2 [2,3].
U potencijalne faktore rizika za nastanak iznenadne srčane smrti
spadaju i remodelovanje električne aktivnosti miokarda posredovano
angiotenzinom 2, povećana simpatička aktivnost u miokardu i produžen
QT interval, tabela 1 [5,6].
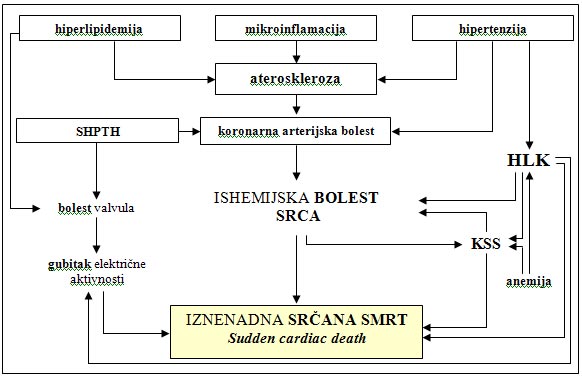
Shema 1. Faktori rizika koji doprinose kardiovaskularnom mortalitetu
bolesnika na dijalizi
Modifikovano prema referenci [2].
HLK - hipertrofija leve komore,
KSS - kongestivna slabost srca, SHPTH - sekundarni
hiperparatireoidizam
Izmenjen srčani elektrofiziološki matriks smanjuje repolarizacionu
rezervu, a to za posledicu ima stečeni produženi QT sindrom kod
bolesnika koji se leče hemodijalizom [7]. Kliničke manifestacije
produženog QT intervala su: torsade de points - TdP polimorfna
ventrikularna tahikardija i iznenadna srčana smrt [7]. Nekardijalni
faktori rizika za stečeni produženi QT sindrom u nefrologiji
uključuju: oštećenu eliminaciju lekova (bubrežna insuficiejncija),
disbalans elektrolita, akutni neurološki događaj (intrakranijalna i
subarahnoidalna hemoragija), diabetes mellitus i poremećaj
nutricije [7].
QT interval odražava trajanje ventrikularne depolarizacije i
repolarizacije. Korigovani QTc interval izračunava se korišćenjem
Bazett-ove formule: QTc= , gde RR reprezentuje vremensko rastojanje
između dve ventrikularne depolarizacije u milisekundima (ms). U
dvanaestokanalnom EKG-u utvrđena je promenljivost u trajanju QT
intervala [8]. Disperzija korigovanog QTc intervala koristi se za
procenu rizika javljanja ventrikularnih aritmija kod bolesnika na
hemodijalizi [9]. Disperzija korigovanog QTc intervala definiše se
kao razlika između najdužeg i najkraćeg QTc intervala registrovanog
elektrokardiogramom sa 12 odvoda [9]. Normalna disperzija QTc
intervala iznosi 40-50 ms. Rizik za serijske ventrikularne aritmije
ili iznenadna srčana smrt dokazan je kod bolesnika sa disperzijom
QTc intervala većom od 50 ms, pa se stoga disperzija QTc intervala
koristi kao prediktor ventrikularnih aritmija i kardiovaskularne
smrtnosti bolesnika sa završnim stadijumom hronične slabosti bubrega
[9]. Bolesnici na hemodijalizi imaju veći stepen produženja QT
intervala u odnosu na bolesnike koji se leče peritoneumskom
dijalizom [9]. Promene u sastavu intracelularne ili intersticijumske
tečnosti znatno povećavaju repolarizaciju ventrikula kod bolesnika
na hemodijalizi. Kalijum, kalcijum, magnezijum i metabolička acidoza
su znatni faktori koji utiču na električnu stabilnost miokarda. U
toku hemodijalizne procedure, povećana disperzija QT intervala
rezultat je niske koncentracije kalcijuma u rastvoru za hemodijalizu
i influx-a magnezijuma u ćelije [9]. Povećana disperzija QTc
intervala kod bolesnika na hemodijalizi je takodje povezana sa
ishemijskom bolešću srca i hipertrofijom leve komore. Zbog toga se
disperzija QTc intervala koristi kao rutinski test u dijaliznim
jedinicama, sa posebnim značajem za bolesnike sa preegzistentnim
bolestima srca (bolestima srca i pre započinjanja lečenja
hemodijalizom) [9].
Autonomni nervni sistem transportuje impulse iz centralnog nervnog
sistema do perifernih organa i odgovoran je za kontrolu frekvencije
srčanog rada, krvnog pritiska i respiratorne aktivnosti [10]. Promenljivost
frekvencije srčanog rada (heart rate variability - HRV) se
preporučuje kao neinvazivan metod za ispitivanje/procenu autonomnog
uticaja na srce [10]. Povećan rizik od iznenadne srčane smrti
povezan je sa oštećenom autonomnom fukcijom i značajnim smanjenjem u
promenljivosti frekvencije srčanog rada, tabela 2 [10]. Koronarna
arterijska bolest je znatan faktor rizika za smanjenje
promenljivosti frekvencije srčanog rada [10].
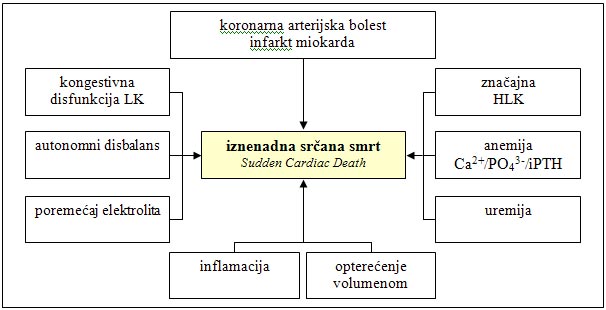
Shema 2. Potencijalni faktori rizika za iznenadnu srčanu smrt
Modifikovano prema referenci [2].
HLK - hipertrofija leve komore,
iPTH - intaktni parathormon
Tabela 1. Potencijalni faktori za povećanje rizika od iznenadne
srčane smrti kod bolesnika koji se leče hemodijalizom
| R. br. |
faktori rizika |
| 1 |
hipertrofija leve komore (koncentrična/ekscentrična) |
| 2 |
poremećaj sistolne funkcije leve komore |
| 3 |
povećana aktivnost simpatičkog nervnog sistema |
| 4 |
fibroza intersticijuma miokarda |
| 5 |
bolest malih krvnih sudova miokarda |
| 6 |
brze izmene elektrolita i statusa volemije u toku
dijalizne seanse |
| 7 |
hiperfosfatemija |
| 8 |
opstruktivna sleep apnea |
| 9 |
produžen QTc interval (disperzija QTc intervala) |
| 10 |
remodelovanje električne aktivnosti miokarda izazvano
angiotenzinom 2 |
Modifikovano prema referenci [5]
Tabela 2. Potencijalni faktori rizika za nastanak iznenadne srčane
smrti kod bolesnika sa završnim stadijumom hronične slabosti bubrega
koji se leče hemodijalizom
| R. br. |
faktori rizika |
| 1 |
muški pol |
| 2 |
godine starosti |
| 3 |
dijabetes melitus |
| 4 |
opstruktivna sleep apnea |
| 5 |
hipertrofija leve komore |
| 6 |
koronarna arterijska bolest |
| 7 |
intermitentni tretman sa dijalizom |
| 8 |
smanjena promenljivost frekvencije srčanog rada - HRV |
| 9 |
produžen QTc in |
Modifikovano prema referenci [10]
Smanjenje stope iznenadne srčane smrti zahteva agresivnije lečenje
ishemijske bolesti srca, širu upotrebu blokatora konvertaze
angiotenzina 1/blokatora receptora za angiotenzin 2 i beta blokatora,
kao i veću učestalost i/ili noćnu hemodijalizu (8-10 sati 6 puta
nedeljno) [10]. ACE inhibitori i β-blokatori povećavaju uticaj
parasimpatikusa na srce, povećavaju promenljivost frekvencije
srčanog rada i smanjuju rizik od iznenadne srčane smrti kod
bolesnika koji se leče hemodijalizom [10]. PATOGENEZA IZNENADNE SRČANE SMRTI
Dva glavna mehanizma nastanka iznenadne srčane smrti su srčani
zastoj (cardiac arrest) i ventrikularna tahikardija/ventrikularna
fibrilacija. Prevalencija srčanog zastoja kod bolesnika u toku
hemodijalize iznosi 0,007% (7/100.000 hemodijaliznih seansi) [11].
Bolesnici koji se dijaliziraju sa koncentracijom K+ u rastvoru od 0
- 1,0 mmol/l imaju dva puta veći rizik od razvoja srčanog zastoja
[11]. U faktore rizika za nastanak srčanog zastoja kod bolesnika na hemodijalizi spadaju: aterosklerotske kardiovaskularne bolesti,
autonomna disfunkcija, hiperkoagulabilnost, anemija, hipertrofija
leve komore, preopterećenje volumenom, anemija, dislipidemija,
hiperhomocisteinemija, kalcifikacije koronarnih arterija i srčanog
mišića, inflamacija i različiti metabolički poremećaji (hiperkaliemija
i hipokaliemija, hipokalciemija i hiperkalciemija, hiperfosfatemija
i sekunadarni hiperparatireoidizam) [11]. Laboratorijski monitoring
u toku hemodijalize i propisivanje odgovarajućeg rastvora za
hemodijalizu znatno smanjuju incidenciju srčanog zastoja u
dijaliznim jedinicama u toku hemodijalizne seanse [11].
Incidencija ventrikularne ektopične aktivnosti za vreme hemodijalize
kreće se u rasponu 18-76%. Kao potencijalni faktori rizika za
ektopičnu aktiv-nost komora kod bolesnika na hemodijalizi razmatraju
se: godine starosti preko 55, oštećena funkcija leve komore,
hipertrofija leve komore, sistolna hipertenzija, povećana serumska
koncentracija kalcijuma i fosfata i parathormona, upotreba digoksina,
acetatnog rastvora za hemodijalizu i upotreba dijalizatora sa
kuprofanskom membranom [11]. Nekorigovana metabolička acidoza,
hipokaliemija i hipokalcemija produžavaju QTc interval i povećavaju
rizik od nastanka ventrikularnih srčanih aritmija [11].
STRATEGIJA ZA SPREČAVANJE NASTANKA IZNENADNE SRČANE SMRTI KOD
BOLESNIKA NA HEMODIJALIZI
Otkrivanje bolesnika na hemodijalizi koji imaju povećan rizik za
pojavu iznenadne srčane smrti je glavni zadatak nefrologa.
Strategija za otkrivanje bolesnika treba da uključi određivanje
koncentracije srčanih troponina u serumu, troponina I i troponina
T. Elektrokardiografski pokazatelji takođe imaju značajnu ulogu u
otkrivanju visokorizičnih bolesnika na hemodijalizi, kao što je
dužina QTc intervala (produžena QTc disperzija). Autonomna
disfunkcija i niska koncentracija jona K+ u dijalizatu znatno
povećavaju rizik za razvoj iznenadne srčane smrti kod bolesnika na hemodijalizi
[12].
Mortalitet bolesnika koji se leče dijalizom (dijaliznih bolesnika)
je izrazito visok, sa jednogodišnjom stopom smrtnosti od
~ 23%.
Iznenadna srčana smrt je znatan uzrok smrti bolesnika koji se leče
dijalizom, odgovorna je za ~ 60% svih srčanih smrti (svih kardiovaskularnih uzroka smrti) i 25% od opštih uzroka smrti (od
svih uzroka smrti). Visoka stopa iznenadne srčane smrti kod
bolesnika koji se leče hemodijalizom zahteva otkrivanje faktora
rizika i pravovremenu primenu preventivnih intervencija [13].
Strategija za smanjenje iznenadne srčane smrti kod bolesnika koji se
leče dijalizom uključuje primarnu i sekundarnu preventivnu
strategiju [12,13]. Primarna preventivna strategija uključuje medikamentnu terapiju i promenu preskripcije dijalizne
terapije (modalitet dijalize), dok sekundarna preventivna
strategija uključuje koronarnu revaskularizaciju i ugradnju implantabilnog kardioverterdefibrilatora, tabela 3
[12,13].
Tabela 3. Terapijski postupci/intervencije za smanjenje nastanka
iznenadne srčane smrti
| R. br. |
Terapijski cilj |
Terapijski postupak |
| 1 |
korekcija ishemije |
β-blokatori, koronarna revaskularizacija |
| 2 |
prevencija rupture plaka |
statini, ACE inhibitori, aspirin |
| 3 |
stabilizacija autonomnog disbalansa |
β-blokatori, ACE inhibitori |
| 4 |
popravljanje pumpne funkcije srca |
ACE inhibitori, β-blokatori |
| 5 |
prevencija aritmija |
β-blokatori, amiodaron |
| 6 |
završno lečenje aritmija |
implatabilni kardioverter defibrillator |
| 7 |
prevencija preoblikovanja leve komore |
blokatori receptora za aldosteron |
Modifikovano prema referenci [13]
PRIMARNA PREVENTIVNA STRATEGIJA
MEDIKAMENTNA TERAPIJA
Medikamentna terapija sastoji se u primeni anti-agregacione
terapije, beta blokatora, blokatora reninangiotenzin sistema
(RAS), blokatora aldoste-rona, primeni eritropoetina i primeni
aktivnog metabolita vitamina D [5].
Rezultati nedavnih ispitivanja pokazuju da se u bubrezima produkuje
enzim koji razgrađuje kateholamine (aminooxydase "renalase").
Smanjeno stvaranje renalaze praćeno je povećanjem koncentracije
kateholamina u plazmi/serumu bolesnika koji boluju od bubrežne
slabosti [13]. U samom intersticijumu miokarda bolesnika koji se
leče hemodijalizom takođe je dokazana povećana koncentracija
norepinefrina [5]. Povećana aktivnost simpatičkog nervnog sistema
kod bolesnika koji se leče hemodijalizom uključena je u patogenezu
hipertrofije leve komore, koronarne arterijske bolesti, srčane
slabosti i srčanih aritmija
[14]. Primena beta blokatora (karvedilola)
kod bolesnika koji se leče hemodijalizom i imaju dilatativnu
kardiomiopatiju, znatno sprečava pojavu kardiovaskularnog mortaliteta
[15,16]. I pored dokazanog zaštitnog dejstva beta blokatora, oni se
primenjuju kod manje od 30% bolesnika koji se leče hemodijalizom,
tabela 4 [14-16].
Upotreba antagonista RAS-a redukuje hipertenziju, dovodi do
regresije hipertrofije leve komore, popravlja komplijansu velikih
arterija i čuva rezidualnu renalnu funkciju kod dijaliznih
bolesnika [13].
Anemija je nezavisan faktor rizika za razvoj hipertrofije leve
komore kod bolesnika na hemodijalizi, a sama hipertrofija leve
komore je nezavisan prediktor razvoja iznenadne srčane smrti [13].
Primena eritropoetina treba da omogući ostvarivanje ciljne vrednosti
hemogliobina od 110-120 g/l. Vrednosti hemoglobina veće od 120 g/l
povećavaju arterijski krvni pritisak, rizik od tromboze vaskularnog
pristupa, a mogu dovesti i do povećanog broja neželjenih
kardiovaskularnih događaja [13].
Deficit vitamina D [1,25(OH)2D3] i sekundarni hiperparatireoidizam
doprinose razvoju koštanih i kardiovaskularnih bolesti kod bolesnika
na hemodijalizi, shema 3 [17]. Nova terapijska strategija ima za
cilj da spreči gubitak koštanog tkiva i hiperplaziju paratireoidnih
žlezda. Ona uključuje primenu aktivnih metabolita vitamina D,
kalcimimetika i vezivača fosfata koji ne sadrže kalcijum [17-19].
Aktivni metaboliti vitamina D3 su značajni blokatori stvaranja i
oslobađanja renina, dovode do regresije hipertrofije leve komore, a
takođe smanjuju i QT interval [20].
DIJALIZNA TERAPIJA
Dijalizna terapija (hemodijaliza) je znatan faktor rizika za
iznenadnu srčanu smrt. U faktore rizika povezane sa hemodijalizom,
koji znatno utiču na pojavu iznenadne srčane smrti spadaju: doza
dijalize, brze izmene elektrolita (kalijum, kalcijum) i hemodinamska nestabilnost
[13]. Hemodijaliza, per se, smatra se
aritmogenim stimulusom, zbog brzih izmena elektrolita (kalijum,
kalcijum) i kardiovaskularne nestabilnosti (intradijalizna
hipotenzija) [13,21]. Optimalna doza dijalize (Kt/V ≥ 1,4), biokompatibilna "high-flux" dijalizna membrana i ultračist rastvor
za hemodijalizu znatno doprinose smanjenju stope mortaliteta ovih
bolesnika [4]. Hemodijafiltracija odstranjuje ne samo male molekule
(< 5kDa), već i molekule srednje molekulske mase (5-50 kDa),
uključujući inflamatorne medijatore, faktor D komplementa, i druge
molekule koje snažno učestvuju u patogenezi kardiovaskularnog
morbiditeta i mortaliteta [13]. Hipotenzija i hemodinamska
nestabilnost ograničavaju postizanje adekvatne ultrafiltracije
intermitentnom hemodijaliznom terapijom kod bolesnika sa poremećajem
sistolne funkcije leve komore. Kod tih bolesnika treba primeniti
alternativne modalitete dijalize [22]. Peritoneumska dijaliza je
modalitet dijalize koji je indikovan kod bolesnika sa poremećajem
sistolne funkcije leve komore, zbog odsustva značajne hemodinamske
fluktuacije povezane sa konvencionalnom hemodijalizom. Nova
dijalizna strategija uključuje: kratku svakodnevnu hemodijalizu (short
daily haemodialysis - SDHD) od 1,5-2,0 časa dijalize tokom 5-6 dana
nedeljno ili noćnu kućnu hemodijalizu (nocturnal home haemodialysis
- NHD), sa trajanjem pojedinačne hemodijalizne seanse od 6-8 sati,
tokom 4-6 noći nedeljno [22].
SEKUNDARNA PREVENTIVNA STRATEGIJA
KORONARNA REVASKULARIZACIJA
Rizik od smrti posle koronarne revaskularizacije znatno je veći kod
bolesnika koji se leče hemodijalizom, u odnosu na opštu populaciju.
Stopa iznenadne srčane smrti je podjednaka kod bolesnika koji se
leče hemodijalizom nakon optimalne koronarne revaskularizacije i
ostalih bolesnika koji se leče hemodijalizom (opšta dijalizna
populacija) [13]. To znači da se i nakon koronarne revaskularizacije
održava veliki aritmogeni potencijal za razvoj iznenadne srčane
smrti kod ovih bolesnika [13]. Koronarna revaskularizacija je
parcijalna, nekompletna terapija za bolesnike sa završnim stadijumom
hronične slabosti bubrega koji se leče hemodijalizom. Zbog toga
terapijska strategija pored koronarne revaskularizacije treba da
uključi i druge intervencije za smanjenje rizika od iznenadne srčane
smrti (strategiju za "neishemijski" doprinos nastanku iznenadne
srčane smrti), u cilju popravljanja dugoročnog preživljavanja ovih
bolesnika [2,3].
Tabela 4. Farmakološke karakteristike beta-blokatora kod hroničnih
dijaliznih bolesnika
Modifikovano prema referenci [14].
| Lek |
Put eliminacije |
Maksimalna doza |
Podešavanje
za zHSB |
Indikacije |
Receptori |
| metoprolol |
jetra |
200-400 mg/dan |
100% |
hipertenzija, angina pektoris,
SVPT, akutni IM,
profilaksa IM,
kongestivna srčana slabost |
β1 |
| atenolol |
bubreg |
100 mg/dan |
30-50%
na 96 sati |
hipertenzija, angina pektoris,
posle IM |
β1 |
| labetalol |
jetra |
200-800 mg/dan |
100% |
hipertenzija |
β1/β2/α1 |
| karvedilol |
jetra |
25-50 mg/dan |
100% |
hipertenzija, angina pektoris,
dilatirana LK posle IM,
kongestivna srčana slabost |
β1/β2/α1 |
| propranolol |
jetra |
240-320 mg/dan |
100% |
hipertenzija, aritmije,
angina pektoris |
β1/β2 |
zHSB - završni stadijum hronične slabosti bubrega,
SVPT -
supraventrikularna paroksizmalna tahikardija, IM - infarkt miokarda

Shema 3. Povezanost između bolesti kostiju i kardiovaskularnih
bolesti
Modifikovano prema referenci [17].
HBT - high bone turnover, LBT - low bone turnover, SHPTH -
sekundarni hiperparatireoidizam
DIJALIZNA TERAPIJA
Dijalizna terapija (hemodijaliza) je znatan faktor rizika za
iznenadnu srčanu smrt. U faktore rizika povezane sa hemodijalizom,
koji znatno utiču na pojavu iznenadne srčane smrti spadaju: doza
dija-lize, brze izmene elektrolita (kalijum, kalcijum) i
hemodinamska nestabilnost [13]. Hemodijaliza, per se, smatra se
aritmogenim stimulusom, zbog brzih izmena elektrolita (kalijum,
kalcijum) i kardiovaskularne nestabilnosti (intradijalizna
hipotenzija) [13, 21]. Optimalna doza dijalize (Kt/V ≥ 1,4), biokompatibilna "high-flux" dijalizna membrana i ultračist rastvor
za hemodijalizu znatno doprinose smanjenju stope mortaliteta ovih
bolesnika [4]. Hemodijafiltracija odstranjuje ne samo male molekule
(< 5kDa), već i molekule srednje molekulske mase (5-50 kDa),
uključujući inflamatorne medijatore, faktor D komplementa, i druge
molekule koje snažno učestvuju u patogenezi kardiovaskularnog
morbiditeta i mortaliteta [13]. Hipotenzija i hemodinamska
nestabilnost ograničavaju postizanje adekvatne ultrafiltracije
intermitentnom hemodijaliznom terapijom kod bolesnika sa poremećajem
sistolne funkcije leve komore. Kod tih bolesnika treba primeniti
alternativne modalitete dijalize [22]. Peritoneumska dijaliza je
modalitet dijalize koji je indikovan kod bolesnika sa poremećajem
sistolne funkcije leve komore, zbog odsustva značajne hemodinamske
fluktuacije povezane sa konvencionalnom hemodijalizom. Nova
dijalizna strategija uključuje: kratku svakodnevnu hemodijalizu (short
daily haemodialysis - SDHD) od 1,5-2,0 časa dijalize tokom 5-6 dana
nedeljno ili noćnu kućnu hemodijalizu (nocturnal home haemodialysis
- NHD), sa trajanjem pojedinačne hemodijalizne seanse od 6-8 sati,
tokom 4-6 noći nedeljno[22].
IMPLANTABILNI KARDIOVERTER-DEFIBRILATOR
Kod bolesnika koji se leče hemodijalizom, nakon srčanog zastoja
ugradnja implantabilnog kardio-verter-defibrilatora smanjuje rizik
smrti za 42%. U Sjedinjenim Američkim Državama, samo 8% bolesnika
koji se leče hemodijalizom i koji su preživeli epizodu srčanog
zastoja, ima iz preventivnih razloga ugrađen implantabilni kardioverter
defibrilator [13]. Implantacija kardioverter-defibrilatora povezana
je sa povećanim rizikom krvavljenja, infekcije i razvojem
subokluzije i okluzije vene, tako da se ugradnja vrši na strani
suprotnoj od strane vaskularnog pristupa za hemodijalizu [2].
Kod bolesnika kod kojih postoji visoki rizik za nastanak iznenadne
srčane smrti (bolesnici koji su preživeli epizodu srčanog zastoja)
indikovana je ugradnja kardioverter-defibrilatora [5, 13]. Klinički
značaj ugradnje implantabilnog kardioverter-defibrilatora u cilju
sprečavanja iznenadne srčane smrti kod bolesnika koji se leče
hemodijalizom tek treba da procene prospektivne, dobro kontrolisane,
randomizovane kliničke studije (ICD2 - Implantable Cardioverter
Defibrilator in Dialysis Patients study) [13]. |
|
|
|
| |
|
|
LITERATURA
- Nakamura S, Ogata C, Aihara N, Sasaki O, Yoshihara F,
Nakahama H, et al. QTc dispersion in haemodialysis patients with
cardiac complications. Nephrology 2005; 10: 113-118
- Herzog CA, Mangrum M, Passman R. Sudden Cardiac Death and
Dialysis Patients. Semin Dial 2008; 21: 300-307
- Herzog CA, Strief JW, Collins A, Gilbertson DT. Cause-specific
mortality of dialysis patients after coronary revascularisation:
why don,t dialysis patients have better survival after coronary
intervention? Nephrol Dial Transplant 2008; 23: 2629-2633
- Herzog CA. Can We Prevent Sudden cardiac Death in Dialysis
Patients? Clin J Am Soc Nephrol 2007; 2: 410-412
- Ritz E, Wanner C. The Challenge of Sudden Death in Dialysis
Patients. Clin J Am Soc Nephrol 2009; 3: 920-929
- Kuhlmann U, Bormann FG, Becker HF. Obstructive sleep apnea:
clinical signs, diagnosis and treatment. Nephrol Dial Transplant
2009; 24: 8-14
- Gussak I, Gussak HM. Sudden cardiac death in nephrology:
focus on acquired long QT syndrome. Nephrol Dial Transplant
2007; 22: 12-14
- Meier P, Vogt P, Blanc E. Ventricular Arrhythmias and Sudden
Cardiac Death in End-Stage Renal Disease Patients on Chronic
Hemodialysis. Nephron 2001; 87: 199-214
- Wu V-C, Lin L-Y, Wu K-D. QT interval dispersion in dialysis
patients. Nephrology 2005; 10: 109-112
- Ranpuria R, Hall M, Chan CT, Unruh M. Heart rate variability
(HRV) in kidney failure: measurement and consequence of reduced
HRV. Nephrol Dial Transplant 2008; 23: 444-449
- Karnik JA, Young BS, Lew NL, Herget M, Dubinsky C, Lazarus
JM, et al. Cardiac arrest and sudden death in dialysis units.
Kidney Int 2001; 60: 350-357
- Herzog CA. Cardiac arrest in dialysis patients: Approaches
to alter an abysmal outcome. Kidney Int 2003; 63(Suppl 84):
197-200
- De Bie MK, van Dam B, Gaasbeek A, van Buren M, van Erven L,
Bax JJ, et al. The current status of interventions aiming at
reducing sudden cardiac death in dialysis patients. Eur Heart J
2009; 30: 1559-1564
- Furgeson SB, Chonchol M. -Blockade in Chronic Dialysis
Patients. Semin Dial 2008; 21: 43-48
- Cice G, Ferrara L, Benedetto AD, Russo PE, Marinelli G,
Pavese F, et al. Dilated Cardiomyopathy in Dialysis-Benefical
Effects of Carvedilol: A Double-Blind, Placebo-Controlled Trial.
J Am Coll Cardiol 2001; 37: 407-411
- Cice G, Ferrara L, D,Andrea A, D,Isa S, Benedetto AD,
Cittadini A, et al. Carvedilol Increases Two-Year Survival in
Dialyisi Patients Wizh Dilated Cardiomyopathy. J Am Coll Cardiol
2003; 41: 1438-1444
- Raggi P, Kleerekoper M. Contribution of Bone and Mineral
Abnormalities to Cardiovascular Disease in Patients with Chronic
Kidney Disease. Clin J Am Soc Nephrol 2008; 3: 836-843
- Messa P, Macario F, Yaqoob M, Bouman K, Braun J, von
Albertini B, et al. The OPTIMA Study: Assessing a New Cinacalcet
(Sensipar/Mimpara) Treatment Algorithm for Secondary
Hyperparathyroidism. Clin J Am Soc Nephrol 2008; 3: 36-45
- Bushinsky DA, Messa P. Efficacy of Early Treatment with
Calcimimetics in Combination with Reduced Doses of Vitamin D
Sterols in Dialysis Patients. NDT plus 2008; 1(Suppl 1): 18-23
- Kim HW, Park CW, Shin YA, Kim YS, Shin SJ, Choi EJ, et al.
Calcitriol regresses cardiac hypertrophy and QT dispersion in
secondary hyperparathyreoidism on hemodialysis. Nephron Clin
Pract 2006; 102: 21-29
- Beumi M, Coppolino G, Bolignano D, Sturiale A, Campo S,
Buemi A, et al. Arrhythmias and Hemodialysis: Role of Potassium
and New Diagnostic Tools. Ren Fail 2009; 31: 75-80
- Sood MM, Pauly RP, Rigatto C, Komenda P. Left ventricular
dysfunction in the haemodialysis population. NDT Plus 2008; 1:
199-205
|
|
|
|



