| |
|
|
UVOD
Kalcifikacija srčanih valvula je čest klinički nalaz kod
bolesnika sa uznapredovalim stadijumom hronične bubrežne bolesti
(HBB) [1]. Dok je prevalenca kalcifikacije mitralne i aortne valvule
u opštoj populaciji starosti ≥75 godina oko 2-10% [2], procenjuje se
da je prevalenca kod bolesnika sa oštećenom bubrežnom funkcijom
srodnih po starosti i polu 5-10 puta veća [3]. Prema rezultatima
nekih studija, kalcifikacija srčanih valvula se nalazi kod približno
polovine bolesnika lečenih hemodijalizom[4]. Patogenetski mehanizmi
odgovorni za razvoj valvularnih kalcifikacija nisu u potpunosti
razjašnjeni. Neka istraživanja ukazuju da kalcifikacija srčanih
valvula deli zajedničke faktore rizika i slične patogenetske
karakteristike sa aterosklerozom: starije životno doba, muški pol,
hipertenzija, pušenje, hiperholesterolemija i diabetes mellitus [5].
Međutim, kod bolesnika sa HBB često se ističu deranžmani mineralnog
metabolizma i gubitak inhibitora kalcifikacija kao predominantni
faktori koji doprinose taloženju i progresiji kardiovaskularnih
kalcifikacija [6, 7].
Kalcifikacija srčanih valvula je značajno povezana sa
kardiovaskularnim morbiditetom, kao i ukupnim i kardiovaskularnim
mortalitetom bolesnika koji se leče dijalizom [8, 9]. Razlozi za to
nisu definitivno rasvetljeni. Kalcifikacija mitralnog anulusa je
udružena sa većom učestalošću poremećaja srčanog ritma i sprovođenja
[10]. Međutim, kalcifikacija aortne valvule može predstavljati
surogatni marker postojeće ateroskleroze ili nekog generalizovanog
inflamatornog procesa [11]. Dokazano je da su kalcifikovane valvule
udružene sa ekstenzivnim kalcifikacijama koronarnih arterija,
karotidnom aterosklerozom i kalcifikacijama, progresivnom stenozom
valvula, hipertrofijom leve komore i srčanom insuficijencijom
[12-14].
Cilj ovog istraživanja je da se utvrdi: a) učestalost kalcifikacije
srčanih valvula kod bolesnika u IV i V stadijumu HBB koji još nisu
započeli lečenje dijalizom; b) povezanost kalcifikacije srčanih
valvula sa kliničkim i laboratorijskim karakteristikama bolesnika,
ehokardiografskim strukturnim parametrima, i ultrazvučnim markerima
karotidne ateroskleroze.
MATERIJAL I METODE
U studiji su učestvovali asimptomatski bolesnici sa četvrtom i
petom fazom HBB u predijaliznom periodu (jačina glomerularne
filtracije (GFR) manja od 30 ml/min), koji se kontrolišu i leče u
Nefrološkoj ambulanti Zdravstvenog centra „Zaječar” u Zaječaru.
Ispitivana grupa je obuhvatila 61 bolesnika (34 muškarca, prosečne
starosti 62,6±13,6 godina), koji nisu imali kliničke dokaze srčane
insuficijencije i/ili koronarne bolesti. Bolesnici sa poznatom
dijagnozom srčane insuficijencije ili koronarne bolesti (tj
bolesnici sa anginom pectoris, upotrebom nitrata i/ili istorijom
infarkta miokarda) su, takođe, isključeni iz studije. Diabetes
mellitus je bio prisutan kod 4 (6,6%) bolesnika, od kojih je 3
primalo insulin. Od hipertenzije je bolovalo 54 (88,5%) bolesnika,
od kojih se 13 lečilo monoterapijom, 24 dvojnom terapijom, a 17
bolesnika je koristilo kombinacije 3 ili više lekova. Kontrolna
grupa je obuhvatila 22 zdrave osobe i bila je srodna po godinama
starosti i po polu sa ispitivanom grupom. Pre započinjanja studije
dobijena je saglasnost Etičkog komiteta i svi ispitanici su
potpisali informisani pristanak o učešću.
Inicijalna klinička procena svakog ispitanika prilikom prve posete
obuhvatila je pregled prethodne medicinske dokumentacije, fizikalni
pregled i popunjavanje upitnika o demografskim podacima, istoriji
bolesti i korišćenim lekovima. Merenje krvnog pritiska je izvršeno
posle deset minuta odmora u sedećem položaju, potom je urađen EKG i
izračunat body mass index (BMI). Uzorci krvi za rutinske hematološke
i biohemijske analize uzeti su posle 12-časovnog noćnog gladovanja.
Intaktni parathormon (iPTH, 1-84) u serumu je određen na
imunohemijskom analizatoru Access, po principu imunoenzimskog
dvostepenog testa. Klirens endogenog kreatinina (CCr, izražen u
ml/min) je izračunat po Cockroft-Gaultovoj formuli [15]. GFR je
izračunata primenom skraćene MDRD formule (Modification of Diet in
Renal Disease Study equation) [16] i prema smernicama Američke
nacionalne fondacije za bolesti bubrega (American National Kidney
Foundation) upotrebljena je za definisanje stadijuma HBB: stadijum
IV, GFR 15-29 ml/min/1,73m2 (n=31) i stadijum V, GFR <15
ml/min/1,73m2 (n=30).
Ehokardiografski pregledi su obavljeni pomoću aparata marke „Toshiba
Power Vision 6000”, multifrekventnom phase array sektorskom sondom
od 2,0 do 4,5 MHz. Ispitanike je pregledao isti ehosonografista koji
prethodno nije bio upoznat sa njihovim identitetom ili kliničkim
statusom, po zajedničkim evropskim i američkim preporukama za
kvantifikaciju srčanih šupljina [17]. Dijagnoza valvularne
kalcifikacije je zasnovana na ehokardiografskim kriterijumima gustih
ehoa u mitralnoj valvuli ili aortnoj valvuli. Od strukturnih
ehokardiografskih parametara, izmereni su: dijametar leve pretkomore
(LA), enddijastolni dijametar leve komore (LVEDD), endsistolni
dijametar leve komore (LVESD), debljina zadnjeg zida leve komore u
dijastoli (PWTd) i debljina interventrikularnog septuma u dijastoli
(IVSTd).
Masa leve komore (LVM) je izračunata iz linearnih dimenzija leve
komore po sledećoj formuli:
LVmass=0,8(1,04[(IVSTd+PWTd+LVEDD)3-LVEDD3])+0,6
Indeks mase leve komore (LVMI) predstavlja odnos LVM/ površina tela.
Hipertrofija leve komore (LVH) je definisana kao LVMI veći od 115
g/m2 za muškarce i 95 g/m2 za žene [17].
Ehosonografski pregled karotidnih arterija urađen je u B modu,
linearnom sondom frekvencije 7,5 MHz, dok su ispitanici ležali u
položaju supinacije sa glavom postavljenom 45% kontralateralno u
odnosu na središnji položaj. Merenje debljine intime-medijalnog
kompleksa (IMT) izvršeno je na zadnjem zidu zajedničke karotidne
arterije, 0,5-1 cm proksimalno od početka karotidnog bulbusa. Pre
merenja IMT izvršen je detaljan pregled prednjeg i zadnjeg zida
distalnog dela a. carotis communis-a u dužini od 2 cm, karotidnog
bulbusa i proksimalnog dela a. carotis interne (2cm), radi
otkrivanja prisustva plakova i kalcifikacija. Kalcifikacije su
definisane kao visoko ehogeni plakovi koji proizvode blještave bele
ehoe sa senkom [18].
Prikupljeni podaci su prvo obrađeni standardnim statističkim
postupcima u cilju dobijanja mera centralne tendencije i mera
varijabiliteta. Testiranje statističke značajnosti razlike izvršeno
je Studentovim t-testom i Mann Whitney-vim testom za numerička
obeležja, a Hi kvadrat testom i Fisher-ovim testom za atributivna
obeležja. Vrednost verovatnoće p <0,05 je prihvaćena kao statistički
značajna.
REZULTATI
Kliničke, laboratorijske i ultrazvučne karakteristike bolesnika
sa HBB (n=61) i zdravih dobrovoljaca srodnih po starosti i polu
(n=22) navedene su u tabeli 1. Od 61 bolesnika sa HBB, kalcifikacije
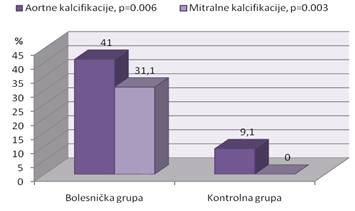
u predelu aortne i mitralne valvule su registrovane kod 29 (47,5%)
bolesnika, a od 22 ispitanika u kontrolnoj grupi valvularne
kalcifikacije su utvrđene kod 2 (9,1%) ispitanika (p=0,001).
Kalcifikacije aortnih valvula su bile prisutne kod ukupno 27 (32,5%)
ispitanika, pri čemu je učestalost u bolesničkoj grupi (25), u
odnosu na učestalost u kontrolnoj grupi (2), bila statistički
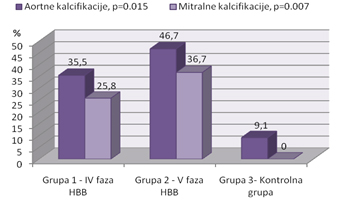
značajno viša (p<0,01), grafikon 1. Ukoliko se posmatra distribucija
frekvencija u odnosu na prisustvo aortnih kalcifikacija kod grupa 1,
2 i 3 (IV faza HBB, V faza HBB, kontrolna grupa), razlika je i dalje
statistički značajna (p<0,05), grafikon 2. Kalcifikacije mitralnih
valvula su bile prisutne kod ukupno 19 (31,1%) ispitanika koji su
pripadali isključivo bolesničkoj grupi, tako da je prikazana
distribucija među grupama takođe bila statistički značajno različita
(p<0,01), grafikon 1. Ukoliko se posmatra distribucija frekvencija u
odnosu na prisustvo mitralnih kalcifikacija kod 3 različite grupe
prema nivou bubrežne funkcije, razlika i dalje ostaje statistički
značajna (p<0,01), grafikon 2.
Bolesnici sa IV i V stadijumom HBB su podeljeni prema prisustvu
valvularnih kalcifikacija u 2 grupe: grupu A, sa kalcifikacijama
(n=29) i grupu B, bez kalcifikacija (n=32). Poređenjem grupe A i B
po demografskim parametrima, zaključeno je da su bolesnici sa
kalcifikacijama u predelu aortne i/ili mitralne valvule značajno
stariji od bolesnika bez kalcifikacija (p<0,01), dok između dve
grupe nije utvrđena statistički značajna razlika u odnosu na pol,
visinu srednjeg arterijskog pritiska ili pušenje. Parametri
nutritivnog statusa (BMI, proteini, albumini, Hb, lipidni parametri)
nisu se značajno razlikovali u odnosu na prisustvo ili odsustvo
valvularnih kalcifikacija. Potvrđena je povezanost valvularnih
kalcifikacija sa bubrežnom funkcijom, pa je klirens kreatinina (CCr)
bio statistički značajno niži u grupi A nego u grupi B (p<0,01). Iz
tabele 2 može se videti da postoji statistički značajna razlika u
prosečnim vrednostima parametara mineralnog metabolizma: P (p<0,05),
proizvoda CaxP (p<0,05) i PTH (p<0,05), između bolesnika sa i bez
kalcifikacija.
Rezultati poređenja strukturnih ehokardiografskih parametara između
dve grupe su prikazani u tabeli 3. Ehokardiografskim pregledom su
utvrđene značajno veće prosečne vrednosti strukturnih parametara LA,
PVTd i IVSTd u grupi A u poređenju sa grupom B (p<0,01). Razlika u
prosečnim vrednostima LVMI između 2 grupe nije dostigla granicu
statističke značajnosti, ali je učestalost HLK bila značajno veća
kod bolesnika sa valvularnim kalcifikacijama (p<0,01). U grupi A
takođe su izmerene značajno veće vrednosti IMT (p<0,001) i
zabeleženo je češće prisustvo kalcifikovanih karotidnih plakova nego
u grupi B (p=0,005).
Tabela 1. Osnovne karakteristike ispitanika u bolesničkoj i
kontrolnoj grupi.
Table 1. Basic characteristics of patients’ group and healthy
control group.
| Variable |
Grupa bolesnika |
Kontrolna grupa |
p |
| Starost (godine) |
62,6±13,6 |
63,7±9,0 |
0,698 |
| Pol (M/Ž) |
34/27 |
12/10 |
0,923 |
| BMI (kg/m2) |
26,1±5,3 |
26,0±3,5 |
0,976 |
| SAP (mmHg) |
102,4±13,0 |
101,7±7,1 |
0,778 |
| Pušenje (%) |
42,6 |
31,8 |
0,375 |
| Hemoglobin (g/dL) |
10,3±1,7 |
13,9±1,2 |
0,000 |
| Albumin (g/L) |
39,0±6,3 |
39,9±3,6 |
0,411 |
| Kreatinin (μmol/L) |
355,0±112,4 |
74,4±16,1 |
0,000 |
| Holesterol (mmol/L) |
5,5±1,4 |
5,4±1,1 |
0,695 |
| Trigliceridi (mmol/L) |
2,1±1,3 |
1,4±0,9 |
0,019 |
| Kalcijum (mmol/L) |
2,4±0,2 |
2,5±0,2 |
0,002 |
| Fosfor (mmol/L) |
1,3±0,3 |
1,0±0,2 |
0,000 |
| iPTH (pg/mL) |
153,8±125,9 |
34,7±22,9 |
0,000 |
| LA (mm) |
43,8±4,9 |
40,5±4,4 |
0,007 |
| PWTd (mm) |
11,0±1,3 |
9,4±1,2 |
0,000 |
| IVSTd (mm) |
11,9±1,5 |
10,5±6,9 |
0,000 |
| LVMI (g/m2) |
170,0±48,9 |
129,7±24,1 |
0,000 |
| LVH (%) |
91,8 |
68,2 |
0,007 |
| IMT (mm) |
0,88±0,17 |
0,72±0,14 |
0,000 |
| Vaskularne kalcifikacije (%) |
60,7 |
27,3 |
0,007 |
Legenda: BMI – body mass index; SAP – srednji arterijski
pritisak; iPTH – intaktni parathormon; LA – leva pretkomora; PWTd –
debljina zadnjeg zida leve komore; IVSTd – debljina
interventrikularnog septuma; LVMI – indeks mase leve komore; LVH –
hipertrofija leve komore; IMT – prosečna debljina intimemedije obe
karotidne arterije.
Grafikon 1. Distribucija ispitanika u odnosu na prisustvo
valvularnih kalcifikacija.
Figure 1. The distribution of subjects according to the presence of
the valvular calcification.
Grafikon 2. Distribucija ispitanika u odnosu na stadijum hronične
bubrežne bolesti
i prisustvo valvularnih kalcifikacija.
Figure 2. The distribution of subjects in relation to chronic kidney
disease stage
and the presence of the valvular calcification.
Tabela 2. Razlike u kliničkim i laboratorijskim karakteristikama
bolesnika sa kalcifikacijama (grupa A) i bez kalcifikacija (grupa B)
srčanih valvula.
Table 2. Differences between clinical and laboratory characteristics
of patients with calcification (group A) and without calcification
(group B) heart valves.
| Parametri |
Grupa A |
Grupa B |
p |
| Starost (godine) |
68,24±10,65 |
57,56±14,14 |
0,002 |
| Pol (% muškaraca) |
44,8 |
65,6 |
0,102 |
| SAP (mmHg) |
104,08±13,34 |
100,83±12,67 |
0,334 |
| BMI (kg/m2) |
25,35±5,69 |
26,71±4,99 |
0,324 |
| Pušenje (%) |
44,8 |
40,6 |
0,740 |
| Hemoglobin (g/dL) |
9,79±1,55 |
10,48±2,39 |
0,187 |
| Ukupni proteini (g/L) |
64,28±7,98 |
67,12±7,75 |
0,163 |
| Albumini (g/L) |
38,34±6,18 |
39,66±6,36 |
0,418 |
| Holesterol (mmol/L) |
5,55±1,13 |
5,48±1,67 |
0,836 |
| LDL holesterol (mmol/L) |
3,46±1,01 |
3,25±1,35 |
0,493 |
| HDL holesterol (mmol/L) |
1,18±0,31 |
1,25±0,35 |
0,433 |
| Trigliceridi (mmol/L) |
2,00±1,07 |
2,14±1,44 |
0,666 |
| Kreatinin (μmol/L) |
365,93±123,18 |
345,06±102,67 |
0,474 |
| Urea (mmol/L) |
19,76±5,48 |
17,44±5,46 |
0,102 |
| CCr (ml/min) |
16,05±5,89 |
23,20±10,69 |
0,002 |
| Ca (mmol/L) |
2,37±0,17 |
2,34±0,16 |
0,553 |
| P (mmol/L) |
1,39±0,31 |
1,23±0,28 |
0,042 |
| CaxP (mmol/L)2 |
3,30±0,75 |
2,87±0,59 |
0,018 |
| Alkalna fosfataza (U/L) |
91,44±49,60 |
73,38±23,89 |
0,080 |
| iPTH (pg/L) |
184,04±150,20 |
120,50±82,35 |
0,048 |
Legenda: SAP – srednji arterijski pritisak; BMI – body mass
index; LDL – low-density lipoprotein; HDL – high-density
lipoprotein; CCr – klirens kreatinina; iPTH – intaktni parathormon.
Tabela 3. Razlike u ehokardiografskim karakteristikama bolesnika sa
kalcifikacijama (grupa A) i bez kalcifikacija (grupa B) srčanih
valvula.
Table 3. Differences between echocardiographic characteristics of
patients with calcification (group A) and without calcification
(group B) heart valves.
| Varijable |
Grupa A |
Grupa B |
p |
| LA (mm) |
4,52±0,48 |
4,25±0,46 |
0,036 |
| PWTd (mm) |
1,13±0,11 |
1,06±0,14 |
0,031 |
| IVSTd (mm) |
1,24±0,14 |
1,15±0,14 |
0,013 |
| LVMI (g/m2) |
181,86±45,23 |
159,19±50,26 |
0,070 |
| LVH (%) |
100 |
84,4 |
0,026 |
| IMT (mm) |
0,94±0,12 |
0,77±0,17 |
0,000 |
| Vaskularne kalcifikacije (%) |
23, 79,3 |
14, 43,8 |
0,005 |
Legenda: LA – leva pretkomora; PWTd – debljina zadnjeg zida leve
komore; IVSTd – debljina interventrikularnog septuma; LVMI – indeks
mase leve komore; LVH – hipertrofija leve komore; IMT – prosečna
debljina intime-medije obe karotidne arterije.
DISKUSIJA
Kalcifikacije miokarda, koronarnih arterija i srčanih valvula su
često prisutne kod bolesnika u terminalnoj fazi HBB. Kalcifikacija
valvula kod ovih bolesnika ne samo da predstavlja rizik za nastanak
stenoze valvula, povećava rizik od pojave infektivnog endokarditisa,
hipetrofije leve komore i srčane slabosti, već je i nezavisni
prediktor kardiovaskularnog mortaliteta [19].
Ehokardiografija je zlatni standard za procenu morfologije i
funkcije srčanih valvula, neinvazivna je i relativno jeftina.
Ehokardiografskim pregledom se kalcifikacije srčanih valvula kod
dijaliznih bolesnika nalaze sa prevalencom koja je nekoliko puta
viša nego u opštoj populaciji, ali je manje dostupnih podataka o
njihovoj učestalosti u ranijim fazama HBB.
Rezultati našeg istraživanja ukazuju da je kalcifikacija mitralnih i
aortnih valvula značajno češća u grupi bolesnika sa IV i V fazom
HBB, nego u kontrolnoj grupi zdravih ispitanika. Zastupljenost
kalcifikacije mitralnih valvula u bolesničkoj i kontrolnoj grupi
bila je 31,1% vs 0% (p<0,01), dok je zastupljenost kalcifikacije
aortnih valvula bila 41% vs 9,1% (p<0,01). Ribeiro i saradnici su
saopštili da je u njihovoj studiji prevalencija mitralnih
kalcifikacija bila 44,5%, a aortnih kalcifikacija 52% kod bolesnika
na hroničnoj HD u odnosu na 10% mitralnih i 4,3% aortnih
kalcifikacija viđenih kod ispitanika sa normalnom bubrežnom
funkcijom (p=0,02 vs p=0,01). U istoj studiji, mitralne i aortne
kalcifikacije su bile udružene sa perifernim arterijskim
kalcifikacijama i poremećajima mineralnog metabolizma [20].
Ehokardiografskom procenom 144 bolesnika koji se leče ponavljanim
hemodijalizama, Raggi i saradnici su došli do sličnih rezultata:
38,2% bolesnika je imalo kalcifikaciju mitralnih valvula, a 44,4%
kalcifikaciju aortnih valvula, i pri tom je dokazano da su
valvularne kalcifikacije kod ovih bolesnika udružene sa značajno
povećanim rizikom ukupnog mortaliteta [21]. Koristeći electron-beam
kompjuterizovanu tomografiju u proceni, Braun i saradnici su
pronašli još veću učestalost valvularnih kalcifikacija kod bolesnika
na HD, 55% aortnih i 59% mitralnih kalcifikacija [22].
U našoj studiji je takođe prikazana razlika u učestalosti
valvularnih kalcifikacija između 3 grupe bolesnika sa različitim
nivoom renalne funkcije. Kalcifikacija mitralnih valvula nije viđena
u kontrolnoj grupi, ali je bila prisutna kod 25,8% bolesnika sa IV
stadijumom HBB i kod 36,7% bolesnika sa V stadijumom HBB (p<0,01).
Kalcifikacija aortnih valvula je zabeležena kod 9,1% ispitanika iz
kontrolne grupe, kod 35,5% bolesnika u IV stadijumu HBB i kod 46,7%
bolesnika u V stadijumu HBB (p<0,05). Slične razlike u odnosu na
nivo bubrežne funkcije su izložene u radu Leskinena i saradnika,
koji su transtorakalnom ehokardiografijom ispitivali učestalost
valvularnih kalcifikacija između 4 grupe ispitanika i njihovu
povezanost sa aterosklerozom. Kombinovana prevalenca mitralnih i
aortnih kalcifikacija je iznosila 31% u predijaliznih bolesnika, 50%
u dijaliznih, 29% u transplantiranih i 12% u kontrolnoj grupi, a
valvularne kalcifikacije su bile usko povezane sa IMT, karotidnim
plakovima, kalcifikovanim karotidnim plakovima, koronarnom bolešću i
perifernom arterijskom bolešću [23]. U grupi bolesnika sa umerenom
HBB (GFR<60 ml/min/1,73m2, 97% učesnika u III stadijumu HBB),
electron-beam ili multi-detector row kompjuterizovanom tomogafijom
je otkriveno 25% bolesnika sa kalcifikacijom aortnih valvula i 20%
sa kalcifikacijom mitralnih valvula [24]. Navedeni podaci podržavaju
teoriju o povezanosti težine valvularnih kalcifikacija i stepena
renalne disfunkcije, iako su i dalje potrebne prospektivne
longitudinalne studije za dokazivanje takve povezanosti.
Mada se valvularne kalcifikacije razmatraju kao marker
ateroskleroze, osim godina starosti, mi nismo našli statistički
značajnu razliku u drugim tradicionalnim aterogenim faktorima rizika
kao što su pol, visina krvnog pritiska, pušenje i holesterol između
bolesnika sa i bez kalcifikacije valvula. Ovi nalazi mogu biti
povezani sa relativno malom veličinom uzorka i načinom uzorkovanja,
jer su u studiju regrutovani samo bolesnici bez klinički manifestne
aterosklerotične vaskularne bolesti kako bi se procenio klinički
značaj valvularnih kalcifikacija kod asimptomatskih bolesnika.
Diabetes mellitus nije procenjivan kao faktor rizika, jer je prema
ovim kriterijumima u studiju uključeno samo 4 bolesnika sa
dijabetesom. Sa druge strane, mi smo našli statistički značajnu
povezanost između valvularnih kalcifikacija i serumskog nivoa
fosfora, proizvoda CaxP i iPTH kod naših bolesnika. Udruženost
valvularnih kalcifikacija i poremećaja mineralnog metabolizma do
sada nije dokazana samo u manjem broju studija [25, 26]. Nivo
serumskog fosfora se pojavljuje kao značajan faktor rizika za
nastanak valvularnih kalcifikacija već kod bolesnika sa blagim do
umerenim stepenom HBB (GFR oko 50ml/min/1,73m2), i kao nezavisan
faktor rizika za kalcifikaciju aortne valvule kod bolesnika na
hemodijalizi [27, 8]. Schlieper i saradnici su saopštili da su
starost, muški pol, dijalizni staž, niži Kt/V, CaxP proizvod i CRP
nezavisni faktori rizika za kardiovaskularne kalcifikacije u kohorti
bolesnika lečenih ponavljanim hemodijalizama, dok su Torun i
saradnici potvrdili da su poznati faktori rizika za kalcifikaciju
aortne i/ili mitralne valvule starije životno doba, duži dijalizni
staž, povišeni krvni P i visok proizvod CaxP [28, 29]. Prema nedavno
objavljenim rezultatima studije Nahie i saradnika, kalcifikacija
aortnih valvula je značajno pozitivno korelirala sa vrednostima
iPTH, fosfora i proizvoda CaxP u grupi dijaliznih bolesnika, odnosno
negativno sa vrednostima kalcijuma, a pozitivno sa vrednostima iPTH
i fosfora u predijaliznoj grupi bolesnika [30]. U skladu sa
prethodnim saznanjima, dokazano je da progresija valvularnih
kalcifikacija može biti usporena intervencijama koje menjaju
metabolizam Ca, P i PTH kod bolesnika na hemodijalizi [31,32].
Hipertrofija leve komore je visoko prevalentna već kod bolesnika u
ranijim fazama HBB. Mi smo utvrdili da je zastupljenost LVH u grupi
bolesnika sa IV i V stadijumom HBB 91,8% u odnosu na 68,2% u
kontrolnoj grupi (p<0,01). Svi bolesnici sa valvularnim
kalcifikacijama imali su LVH (100%), što u odnosu na bolesnike bez
kalcifikacija (84,4%) čini statistički značajnu razliku (p<0,05).
Povezanost između kalcifikacije srčanih valvula i LVH opservirana je
u opštoj populaciji [33] i više puta prikazana kod bolesnika sa CKD
lečenih hemodijalizom [25, 34, 35] i peritoneumskom dijalizom [36].
U opštoj populaciji je prikazan nezavisni prediktivni značaj
koncentrične LVH, što ukazuje da koncentrična LVH može
identifikovati osobe sa povećanim rizikom za nastanak valvularnih
kalcifikacija i ujedno sugeriše moguće zajedničke patofiziološke
mehanizme odgovorne za razvoj valvularnih kalcifikacija i LVH [33].
Hipertenzija je zajednički faktor koji učestvuje u razvoju i
progresiji kalcifikacije srčanih valvula i najčešći je uzrok LVH u
opštoj populaciji [33]. Levin i kolege su pokazali da su glavne
determinante LVH kod bolesnika sa HBB sistolna hipertenzija i
anemija [37]. Između 2 grupe naših bolesnika, sa kalcifikacijom i
bez kalcifikacije srčanih valvula, nije postojala statistički
značajna razlika u prosečnim vrednostima krvnog pritiska ili u
stepenu anemije. Hipertenzija je bila prisutna kod 88,5% od ukupnog
broja bolesnika, od kojih 24% uprkos terapiji nije imalo
zadovoljavajuće regulisan krvni pritisak. Bez obzira na ove
rezultate, za definitivno isključenje hipertenzije kao medijatora
povezanosti između LVH i valvularnih kalcifikacija, bilo bi
neophodno praćenje krvnog pritiska senzitivnijim metodama kao što je
24-časovni ambulatorni monitoring krvnog pritiska. Neurohumoralni i
inflamatorni mehanizmi takođe učestvuju u razvoju kardiovaskularnih
kalcifikacija i LVH u opštoj populaciji [33], dok je kod dijaliznih
bolesnika LVH povezana i sa sekundarnim hiperparatireoidizmom i sa
hipervolemijom [38]. Kod bolesnika na hemodijalizi kalcifikacija
srčanih valvula je udružena sa povećanom krutošću arterija, što
rezultira u povećanju after-load-a i razvoju LVH [26]. Kod bolesnika
na peritoneumskoj dijalizi povezanost između valvularnih
kalcifikacija i LVH nije zadovoljavajuće objašnjena [36].
Dosadašnja saznanja ukazuju da isti patogenetski mehanizmi i faktori
rizika učestvuju u nastanku valvularnih i vaskularnih kalcifikacija.
U skladu sa ovim saznanjima, bolesnici sa valvularnim
kalcifikacijama u našoj studiji imali su statistički značajno veću
IMT karotidnih arterija (p<0,.001) i veću zastupljenost
kalcifikovanih karotidnih plakova (p=0,005), nego bolesnici bez
kalcifikacija. U opštoj populaciji sa aterosklerotičnom bolešću
kalcifikacija valvula se razvija u uslovima endotelnog oštećenja i
inflamacije, i deli karakteristike ateroskleroze, uključujući
lipidnu akumulaciju, aktivaciju matriks metaloproteinaze i
interakciju sa rennin-angiotenzin sistemom [39], ali kod bolesnika
sa renalnom disfunkcijom tradicionalnim faktorima rizika se
pridružuju i drugi uzročni mehanizmi. Prema jednoj hipotezi, iz
renalne disfunkcije proizilaze brojni intermedijarni faktori kao što
su inflamacija, hipertenzija ili disregulacija mineralnog
metabolizma čijim se međusobnim delovanjem može objasniti visoka
učestalost valvularnih kalcifikacija u HBB. Međutim, povećani rizik
kalcifikacija može biti uslovljen i kumulativnim efektom nemerenih
ili nekompletno merenih KV faktora rizika koji se akumuliraju sa
pogoršanjem renalne funkcije i mogu odražavati zajednički osnovni
patološki proces kao što je ateroskleroza [40]. U publikaciji Wang-a
i saradnika, ukupni i kardiovaskularni mortalitet bolesnika na
peritoneumskoj dijalizi nije se značajno razlikovao u odnosu na to
da li su oni imali valvularne kalcifikacije ili aterosklerotičnu
vaskularnu bolest, što govori u prilog hipotezi da valvularne
kalcifikacije predstavljaju marker sistemske KVB [9]. U drugoj
publikaciji, ista grupa je pokazala interakciju između nivoa
feritina-A, malnutricije, inflamacije, ateroskleroze i valvularnih
kalcifikacija u izazivanju neželjenog ishoda kod bolesnika na
peritoneumskoj dijalizi [41].
ZAKLJUČAK
Rezultati prezentovane studije pokazuju da je kalcifikacija
srčanih valvula često prisutna kod asimptomatskih bolesnika u IV i V
stadijumu HBB pre početka dijaliznog lečenja i da je učestalost
kalcifikacija direktno proporcionalna težini renalne disfunkcije.
Naša studija je potvrdila da bubrežne bolesnike sa valvularnim
kalcifikacijama karakteriše starije životno doba, deranžmani
mineralnog metabolizma i strukturne abnormalnosti miokarda koje se
manifestuju hipertrofijom leve komore. Povezanost koju smo pronašli
između valvularnih kalcifikacija, karotidne ateroskleroze i
kalcifikovanih karotidnih plakova ukazuje da valvularne
kalcifikacije mogu poslužiti kao marker ateroskleroze i arterijskih
kalcifikacija kod ovih bolesnika. Potrebna su dalja istraživanja da
bi se u potpunosti razjasnili komplikovani patofiziološki mehanizmi
odgovorni za nastanak valvularnih kalcifikacija u uznapredovalom
stadijumu HBB.
LITERATURA
- Raga P, Boulay A, Chasan-Taber S, Amin N, Dillon M, Burke
SK, et al. Cardiac calcification in adult hemodialysis patients:
a link between end-stage renal disease and cardiovascular
disease? J Am Coll Cardiol 2002; 39: 695-701.
- Blaha MJ, Budoff MJ, Rivera JJ, Khan AN, Santos RD, Shaw LJ,
et al. Relation of aortic valve calcium detected by cardiac
computed tomography to all-cause mortality. Am J Cardiol 2010;
106: 1787-91.
- Nkomo VT, Gardin JM, Skelton TN, Gottdiener JS, Scott CG,
Enriquez-Sarano M. Burden of valvular heart diseases: a
population-based study. Lancet. 2006; 368: 1005-11.
- Varma R, Aronow WS. McClung JA, Garrick R, Vistainer PF,
Weiss MB, et al. Prevalence of valve calcium and association of
valve calcium with coronary artery disease, atherosclerotic
vascular disease, and all-cause mortality in 137 patients
undergoing hemodialysis for chronic renal failure. Am J Cardiol
2005; 95: 742-3.
- Miller JD, Weiss RM, Heistad DD. Calcific aortic valve
stenosis: methods, models, and mechanisms. Cirs Res 2011; 108:
1392-412.
- Ketteler M, Westenfeld R, Schlieper G, Brandenburg V.
Pathogensis of vascular calcification in dialysis patients. Clin
Exp Nephrol 2005; 9: 265-70.
- Moe SM, Reslerova M, Ketteler M, O'neill K, Duan D, Koczman
J, et al. Role of calcification inhibitos in the pathogenesis of
vascular calcification in chronic kidney disease (CKD). Kidney
Int 2005; 67: 2295-304.
- Petrović D, Obrenović R, Stojimirović B. Risk Factors for
Aortic Valve Calcification in Patients on Regular Hemodialysis.
Int J Artif Organs 2009; 32: 173-9.
- Wang AY, Wang M, Woo J, Lam CW, Li PK, Lui SF, et al.
Cardiac valve calcification as an important predictor for
all-cause mortality and cardiovascular mortality in long-term
peritoneal dialysis patients: a prospective study: J Am Soc
Nephrol 2003; 14: 159-68.
- Mazzaferro S, Coen G, Bandini S, Borgatti PP, Ciaccheri M,
Diacinti D, et al. Role of ageing, chronic renal failure and
dialysis in the calcification of mitral annulus. Nephrol Dial
Transplant 1993; 8: 335-40.
- Chandra HR, Goldstein JA, Choudhary N, O'Neill CS, George
PB, Gangasani SR et al. Adverse outcome in aortic sclerosis is
associated with coronary artery disease and inflammation. J Am
Coll Cardiol 2004; 43: 169-75.
- Bellasi A, Ferramosca E, Muntner P, Ratti C, Wildman RP,
Block GA, et al. Correlation of simple imaging tests and
coronary artery calcium measured by computed tomography in
hemodialysis patients. Kidney Int 2006; 70: 1623-8.
- Wang AY, Ho SS, Wang M, Liu EK, Ho S, Li PK, et al. Cardiac
valvular calcification as a marker of atherosclerosis and
arterial calcification in end-stage renal disease. Arch Intern
Med 2005; 165: 327-32.
- Dweck MR, Boon NA, Newby DE. Calcific aortic stenosis: a
disease of the valve and the myocardium. J Am Coll Cardiol 2012;
60: 1854-63.
- Cockcroft DW, Gault MH. Prediction of creatinine clearance
from serum creatinine. Nephron 1976;16:31-41.
- National Kidney Foundation. K/DOQI clinical practice
guidelines for chronic kidney disease: evaluation,
classification, and stratification. Am J Kidney Dis 2002; 39:
S1-S266.
- Lang RM, Bierig M, Devereux RB, Flachskampf FA, Foster E,
Pellikka PA, et al. Recommendations for chamber quantification.
Eur J Echocardiogr 2006; 7: 79-108.
- Savage T, Clarke AL, Giles M et al. Calcified plaque is
common in the carotid and femoral arteries of dialysis patients
without clinical vascular disease. Nephrol Dil Transplant 1998;
13: 2004-2012.
- Salusky IB, Goodman WG. Cardiovascular calcification in
end-stage renal disease Nephrol Dial Transplant 2002; 17: 336-9.
- Ribeiro S, Ramos A, Brandao A, Rebelo JR, Guerra A, Resina
C, et al. Cardiac valve calcification in haemodialysis patients:
role of calcium-phosphate metabolism. Nephrol Dial Transplant
1998; 13: 2037–40.
- Raggi P, Bellasi A, Gamboa C, Ferramosca E, Ratti C, Block
GA, et al. All-cause Mortality in Hemodialysis Patients with
Heart Valve Calcification. Clin J Am Soc Nephrol 2011; 6:
1990-5.
- Braun J, Oldendorf M, Moshage W, Heidler R, Zeitler E, Luft
FC. Electron beam computed tomography in the evaluation of
cardiac calcification in chronic dialysis patients. Am J Kidney
Dis 1996; 27: 394–401.
- Leskinen Y, Paana T, Saha H, Groundstroem K, Lehtimaki T,
Kilpinen S, et al. Valvular calcification and its relationship
to atherosclerosis in chronic kidney disease. J Heart Valve Dis
2009; 18: 429-38.
- Adenev KL, Siscovick DS, Ix JH, Seliger SL, Shlipak MG,
Jenny NS, et al. Association of Serum Phosphate with Vascular
and Valvular Calcification in Moderate CKD. J Am Soc Nephrol
2009; 20: 381-7.
- Sayarliogly H, Sayarlioglu H, Acar G, Sahin M, Altunoren O,
Coskun Yavuz Y, et al. Prevalence and risk factors of valvular
calcification in hemodialysis patients. Iran J Kidney Dis 2013;
7: 129-34.
- Strozecky Odrowaz-Sypniewska G, Manitius J. Cardiac valve
calcifications and left ventricular hypertrophy in hemodialysis
patients. Ren Fail 2005;27:733-8.
- Adeney KL, Siscovick DS, Ix JH, Seliger SL, Shlipak MG,
Jenny NS, et al. Association of serum phosphate with vascular
and valvular calcification in moderate CKD. J Am Soc Nephrol
2009;20:381-7.
- Schlieper G, Brandenburg V, Đuric Z, Damjanovic T, Markovic
N, Schurgers L, et al. Risk factors for cardiovascular
calcifications in non-diabetic Caucasian haemodialysis patients-
Kidney Blood Press Res 2009;32:161-8.
- Torun D, Sezer S, Baltali M, Adam FU, Erdem A, Ozdemir FN,
et al. Association of cardiac valve calcification and
inflammation in patients on hemodialysis. Ren Fail
2005;27:221-6.
- Nafie ES, Mansour HH, Mohammed RR, Khattab SS, Khaled MF,
Fahmy AM, et al. Assessment of Vascular Calcification in
Egyptian Patients with Chronic Kidney Disease. World J Med Sci
2011;6:183-92.
- Raggi P, Chertow GM, Torres PU, Csiky B, Naso A, Nossuli K,
et al. The ADVANCE study: A randomized study to evaluate the
effects of cincalcet plus low-dose vitamin D on vascular
calcification in patients on HD. Nephrol Dial Transplant
2011;26:1327-39.
- Raggi P, Bommer J, Chertow GM. Valvular calcification in
hemodialysis patients randomized to calcium-based phosphorus
binders or sevelamer. J Heart Valve Dis 2004;13:134-41.
- Elmariah S, Delaney JA, Bluemke DA, Budoff MJ, O'Brien KD,
Fuster V, et al. Associations of LV hypertrophy with prevalent
and incident valve calcification: Multi-Ethnic Study of
Atherosclerosis. JACC Cardiovasc Imaging 2012; 5: 781-8.
- Turkmen F, Emre A, Ozdemir A, Sevinc C, Erisken E,
Yesilcimen K. Relationship between aortic valve sclerosis and
left ventricular hypertrophy in chronic haemodialysis patients.
Int Urol Nephrol 2008; 40: 497-502.
- Ventura JE, Tavella N, Romero C, Petraglia A, Báez A, Muñoz
L. Aortic valve calcification is an independent factor of left
ventricular hypertrophy in patients on maintenance
haemodialysis. Nephrol Dial Transplant. 2002; 17: 1795-801.
- Yilmaz M, Unsal A, Oztekin E, Kesmezacar O, Kaptanogullari
OH, Eren N. The prevalence of hypertension, valve calcification
and left ventricular hypertrophy and geometry in peritoneal
dialysis patients. Kidney Blood Press Res. 2012; 35: 431-7.
- Levin A. Clinical epidemiology of cardiovascular disease in
chronic kidney disease prior to dialysis. Semin Dial 2003; 16:
101-5.
- Covic A, Mardare NG, Ardeleanu S, Prisada O, Gusbeth-Tatomir
P, Goldsmith Đ. Serial echocardiographic changes in patients on
hemodialysis: an evaluation of guideline implementation. J
Nephrol 2006; 19: 783-93.
- Mohler ER, 3rd. Mechanismis of aortic valve calcification.
Am J Cardiol 2004; 94: 1396-402.
- Asselbergs FW, Mozaffarian D, Katz R. Association of renal
function with cardiac calcifications in older adults: the
cardiovascular health study. Nephrol Dial Transplant 2009; 24:
834-40.
- Wang AY, Woo J, Lam CW, Wang M, Chan IH, Gao P, et al.
Associations of serum fetuin-A with malnutrition, inflammation,
atherosclerosis and valvular calcification syndrome and outcome
in peritoneal dialysis patients. Nephrol Dial Transplant 2005;
20: 1676-85.
|
|
|
|


