| |
|
|
UVOD
Clostridium difficile je prvi put opisan kao uzrok proliva 1978.
godine. Ova anaerobna bakterija je odgovorna za nastanak kolitisa
udruženog sa uzimanjem antibiotika. Clostridium difficile infekcija
(KDI) je najčešći uzrok zaraznih bolničkih diareja u SAD. Sada je uz
meti-cilin-rezistentni stafilokok i vankomicin - rezistentni
enterokok među tri vodeće bolnič-ke infekcije u svetu [1,2]. Uprkos
napretku u kontroli infekcije i novijih mogućnosti za lečenje KDI,
prisutan je stalan i značajan porast učestalosti i ozbiljnosti KDI,
kao i povećan morbiditet i mortalitet u vezi sa KDI [2,3]. Ove
promene u epidemiologiji KDI, pripisuju se nastajanju
hipervirulentnog soja C. difficile. Tradicionalno poznati faktori
ri-zika za KDI uključuju bolničko lečenje, poodmaklu životnu dob,
operacije ili lapa-roskopske i endoskopske procedure organa za
varenje i korišćenje antibiotika. Registro-vano je da bolesnici sa
izrazitom leuko-citozom ili akutnom insuficijencijom bubre-ga (koji
obično imaju i ozbiljniju formu KDI) imaju goru prognozu nego oni
koji nemaju te abnormalnosti. [1] Clostridium difficile proi-zvodi
toksine A i B dok neki sojevi bakterije stvaraju binarni toksin.
Toksini izazivaju simptome kolitisa citotoksičnim učinkom na
enterocite, draženjem neurona koji inervišu crevo kao i pokretanjem
jake zapaljenjske rea-kcije. Toksin A ima značajniju ulogu u crevima
dok toksin B ima sistemsko dejstvo. [4]
Epidemiologija KDI
Incidencija KDI je bila stabilna sve do ka-snih 1990-ih. Međutim, od
ranih 2000–tih go-dina incidencija raste i u bolnicama i u op-štoj
populaciji. [1] U nekoliko velikih epide-mioloških studija u SAD,
incidencija bolni-čkih KDI porasla je 2 - 2,5 puta od kasnih 1990-ih
do ranih 2000-ih. Porast incidencije je izrazitiji u starijoj
populaciji. Visoki po-rast incidencije KDI (4 puta za 13 godina) je
zabeležen u Kvebeku, uz ukupnu smrtnost od 6,9% [2]. Bolest je u
porastu i u Evropi. U periodu 2007/2008.godine registrovano je 55502
obolelih u Velikoj Britaniji. U Nemačkoj 2008. godine 58 000
obolelih. U Srbiji se, ta-kođe, registruje porast broja obolelih. U
Infektivnoj klinici KCS u Beogradu, u periodu 2009.-2010. godine od
KDI lečeno 250 bolesnika, a umrlo je 18 (7,2%) [5]. Zavisno od
načina nastanka bolesti, C. difficile infekcija se definiše kao:
1. Stečena van bolnice ako se simptom bolesti javlja van bolnice ili
u roku od 48 sati od prijema u bolnicu, a da osoba nije prethodno
hospitalizovana 12 nedelja ili duže.
2. Stečena u bolnici ako se simptomi pojave posle više od 48 sati
nakon prijema ili manje od četiri nedelje nakon otpusta iz
zdravstvene ustanove.
3. Neodređena ako se simptomi KDI javljaju između 4 i 12 nedelje
nakon otpusta iz bolnice [6]
Teorije koje su se razvile da bi objasnile porast incidencije KDI
uključuju promene u populaciji hospitalizovanih pacijenata (sta-riji
i teže bolesni), promene u propisivanju antibiotika (posebno,
povećano korišćenje no-vije generacije fluorohinolona), novi
zara-zniji sojevi C. difficile, potencijalno novi fa-ktori rizika
(npr. tretman inhibitorima pro-tonske pumpe), promene u sprečavanju
infekcije u svakodnevnoj praksi (npr. korišćenje alko-holnog gela za
pranje ruku). KDI je češća u sta-rijih osoba, koje takođe imaju i
veći rizik da obole od teške forme infekcije ili teške infekcije sa
komplikacijama. Neki autori kao glavni razlog za povećanu
incidenciju kao i za teške forme KDI vide u starenju stanovništva i
sve starijim pacijentima u bolnicama.
Pojava novih "rizičnih" populacija C. difficile infekcije se sada
opisuje i u populacijama koje su tradicionalno imale nizak nivo
rizika kao što su deca i delovi stanovništva koji nemaju uobičajene
faktore rizika [7]. U istraživanju iz SAD -Minesota, veliki procenat
slučajeva (41%) su bili stečeni van bolnica [2] U toj studiji u
periodu 1991. – 2005. godina ukupna incidencija KDI nastalih van
bolnice i onih nastalih u bolnici se povećala za 5,3 puta, odnosno
19,3 puta. Pacijenti sa vanbolnički nastalom KDI bili su mlađi,
često nisu imali u anamnezi nedavne hospitalizacije, i imali su
manje komorbiditetnih faktora. [2] Slično to-me, i druge studije
sugerišu da se KDI sve če-šće pojavljuje kao uzrok proliva u dece,
kako van bolnice tako i u bolnici [8]. Velika stu-dija KDI u dece u
hospitalnim uslovima po-kazala je da se incidencija KDI znatno
pove-ćala. U periodu od 2001. do 2006. godine po-rasla je sa 4,4 na
6,5 slučajeva na 10.000 bo-lesničkih dana. Srednja životna dob ovih
pe-dijatrijskih bolesnika bila je četiri godine, a skoro u jednoj
četvrtini slučajeva pacijenti su bili mlađi od godinu dana [8].
Povećana inci-dencija KDI u opštoj populaciji može biti zbog
povećane učestalosti asimptomatskih kli-conoša. Pokazano je da C.
difficile može kolo-nizovati stolicu u 1% do 3% zdravih odraslih
osoba i čak 30% dece [9]. Dodatni faktori koji doprinose porastu
incidencije vanbolničkih CD infekcija uključuju češće propisivanje
antibiotika, veću upotrebu lekova za spre-čavanje sinteze želudačne
kiseline, konta-minacije prerađenih mesnih proizvoda, više-struki
prenos infekcije sa osobe-na-osobu i povećanu prisustvo spora i
kontaminiranog materijala u okruženju. [9] Povećana pažnja i svest
kliničara, češći pregledi stolice i sumnja da je KDI moguće
objašnjenje proliva, verovatno doprinosi boljoj dijagnostici i
registrovanju povećane incidencije ove infe-kcije.
Nastanak hipervirulenog soja
Važno razmatranje u povećanju učestalosti KDI je pojava
hipervirulentnog soja bakterije, poznat kao ribotyp 027, NAP1
(ribotype 027, NAP1 - North American pulsed-field gel
electrophoresis type 1 ili restriction endonuclease analysis group
BI ). Ovaj soj je izolovan u većini država u SAD i nekoliko zemalja
Evrope. Hipervi-rulentni soj ima varijacije na nivou tcdC sekvence
represor gena, što rezultuje gubitkom funkcije gena da stvara
protein koji normalno dovodi do supresije gena za produkciju toksina
A i B. Usled ove varijacije bakterija produkuje znatno viši nivo
toksina (šesnestostruko povećanje za toksin A i 23 puta za toksin
B). Pored toga toksin se proizvodi u ranijoj fazi infekcije u
log-fazi rasta, dok ne-epidemijski sojevi (sojevi uobičajene
virulentnosti) obi-čno ne proizvode značajne količine toksina sve do
najviše faze rasta - plato faze. [10] Pojava tog hipervirulentnog
soja je povezana s pove-ćanjem incidencije KDI, češćim recidivima,
težom formom bolesti i povećanim mor-talitetom [2,11]. Osim toga,
većina centara čak i u razvijenim zemljama nema mogućnosti
iden-tifikacije hipervirulentnog soja C. difficile i taj podatak
izaziva nedoumice u pogledu izbora terapije.
Faktori rizika za KDI
Tradicionalni faktori rizika za KDI uklju-čuju korišćenje
antibiotika, bolničko leče-nje, i visoku starosnu dob. Poznato je da
normalna bakterijska flora debelog crva pre-dstavlja zaštitu od
kolonizacije C. difficile. Korišćenje sistemskih antibiotika
narušava normalni biotop kolona, povećava mogućnost naseljavanja C.
difficile i povećava rizik pojave KDI 2 - 16 puta. [12] Kolonizacija
C. difficile u adolescenata i starijih osoba [13] udružena je sa
promenama u mikrobnom sadržaju creva. Promena crevne flore koja
nastaje kao rezultat hospitalizacije ili izloženosti antibioti-cima
može dovesti do razvoja KDI. Osim toga, kod osoba sa KDI koje su
dobijale antibiotike vreme izlečenja proliva je duže, procenat
izlečenja je manji a učestalost recidiva KDI je viša. [14] Smatra se
da je primarni način pre-nosa KDI sa jedne osobe na drugu
fekalno-oralnim putem u nečistoj sredini, zagađenim predmetima i
izlučevinama i zaraženim ruka-ma zdravstvenih radnika. Bolesnici sa
KDI stolicom izbacuju i šire spore u okolinu. Ove spore su otporne
na mnoge dezinficijense koji se najčešće koriste u bolnicama [15].
Organi-zam domaćina stvara antitoksine i antitela kao zaštitu protiv
KDI. Međutim, ovaj imunološki odgovor se smanjuje sa starošću. Time
se objašnjava povećana učestalost, ozbilj-nost i ponavljanje KDI u
starijih osoba.
Dodatni, identifikovani, potencijalni fakto-ri rizika za KDI
uključuju veći broj pato-loških stanja: inflamatorne bolesti creva,
imunodeficijenciju, hipoalbuminemiju, mali-gne bolesti,
transplantaciju organa, hemote-rapiju, korišćenje inhibitora
protonske pum-pe (IPP) [16,17]. Poslednjih godina se dosta diskutuje
o ulozi želudačne kiseline u pato-genezi KDI. Postoje podaci koji
sugerišu da kada zaobiđemo potencijalni zaštitni učinak želudačne
kiseline (na primer, uvođenjem postpilorične enteralne prehrane ili
kori-šćenjem IPP i ili blokatora H2 receptora) rizik za pojavu KDI
se poveća 2-3 puta [2,18] Kontroverzni su podaci o tome da li
hloro-vodonična kiselina želuca ubija spore C. difficile. Neke
novije studije ne dokazuju vezu upo-trebe IPP i H2 blokatora i
povećanog rizika za KDI ili vezu između upotrebe IPP i H2 blokatora
i težine KDI. [18] Tako nije do kraja razjašnjeno da li korišćenje
preparata za suzbijanje želudačne kiseline predstavlja nazavisan
faktor rizika za KDI [19]. Ipak, američka agencija za hranu i lekove
- FDA ne-davno je izdala upozorenje da je korišćenje IPP povezano s
povećanim rizikom od KDI.
Prikaz faktora rizika za KDI dat je u tabeli 1.
Tabela 1. Utvrđeni i sigurni faktori rizika za
Clostridium difficile infekciju

Dijagnoza KDI
Dijagnoza KDI se postavlja na osnovu kliničke slike (najčešće bolovi
u trbuhu i proliv), ana-liza stolice i ređe endoskopskih ili
radio-loških pregleda. Postoji nekoliko načina pre-gleda stolice
korisnih u dokazivanju C. difficile. Koriste se koprokultura,
dokazivanje citotoksina u stolici, lančana reakcija poli-meraze,
enzimski imunološki test i test sto-lice na glutamat dehidrogenazu.
Koprokultura na C. difficile smatra se standardnim dijagno-stičkim
kriterijumom. Pre svega, stoga što je senzitivnost ove metode
94%-100%, a speci-fičnost 84%-100% [19]. Međutim, dužina trajanja
pregleda i visoka cena ograničavaju njegovu primenu u svakodnevnoj
praksi. Lanča-na reakcija polimeraze smatra se standardnim
alternativnim izborom u odnosu na kopro-kulturu jer, takođe, ima
odličnu senzitivnost i specifičnost. Međutim, ovaj pregled zahteva
visoku tehničku opremljenost i stručnost i ne pravi razliku između
asimptomatskih klico-noša i simptomatske infekcije. Test stolice na
glutamat dehidrogenazu je po senzitivnosti jednak sa lančanom
reakcijom polimeraze [2,20]. Tradicionalno, najčešće korišćeni test
je enzimski imunoesej, koji se zasniva na antigenskoj detekciji
toksina A i/ili toksina B. Ovaj test ima visoku specifičnost (98%)
ali je ograničen umerenom osetljivošću (50%). Ukoliko je kod
simptomatskih bolesnika nega-tivan treba ga proveriti drugom,
senzi-tivnijom, metodom [20].
Endoskopija se kao inicijalna metoda retko koristi u dijagnozi KDI.
Endoskopski nalaz pseudomembranoznog kolitisa je specifičan i
ukoliko je prisutan, znak je ozbiljne infekcije. Endoskopiji
pristupamo ako postoji diferen-cijalno dijagnostička sumnja na neko
drugo oboljenje ili ako klinički nalaz i labora-torijski testovi
nisu jasni. Isto tako rentgenski pregled abdomena ili
kompju-terizovanu tomografiju (KT) retko koristimo kao početni
dijagnostički postupak. KT može pokazati zadebljanje ili priraslice
debelog creva. Radiološki nalaz dilatiranog kolona u kombinaciji sa
jakim bolovima u trbuhu, leuko-citozom, visokom febrilnošću i
hipotenzi-jom može ukazivati na ozbiljnu komplikaciju KDI – toksični
megakolon.
Identifikovanje teških formi KDI
Spektar težine kliničke slike KDI varira od blage do teške ili teške
sa komplikacijama. Teška forma KDI se karakteriše perifernom
leukocitozom od 15.000/μL ili više i/ili povećanjem koncentracije
kreatinina u serumu 1,5 puta, ili više iznad referentne vrednosti
[6].
Definicija teške forme KDI sa kompli-kacijama uključuje hipotenziju,
šok, sepsu, ileus, toksični megakolon, perforaciju ili posledičnu
smrt [13]. U studijama su identifi-kovani dodatni prediktori teške
forme KDI koje uključuju stariju životnu dob, isto-vremenu
antibiotsku terapiju, korišćenje opo-jnih droga i lekova koji
usporavaju motilitet creva, hipoalbuminemiju, komorbiditete kao što
su hronične bolesti bubrega, povećan broj stolica, visoku febrilnost
i groznicu ili prisustvo pseudomembrana u kolonu. [21,22,23] Važno
je prepoznati teške ili teške infekci-je sa komplikacijama, jer se
preporuke za lečenje KDI baziraju na težini bolesti [6]. Prikaz
faktora rizika povezanih s teškim KDI je dat u Tabeli 2.
Tabela 2. Faktori rizika i pokazatelji teške forme
Clostridium difficile infekcije

Lečenje KDI
Opšte mere
Pacijenti koji su asimptomatski nosioci C. difficile ne bi trebalo
da primaju terapiju jer ne postoje podaci koji upućuju da bi lečenje
ovih osoba sprečilo simptomatske infekcije ili transmisiju bolesti
[6]. Kao i kod drugih bolesti sa dijarealnim sindromom, početno
lečenje uključuje dobru hidraciju kao i pra-ćenje i korekciju
(ukoliko je potrebno) elektr-olitnog statusa pacijenata. Upotrebu
lekova koji usporavaju motilitet creva kao što je loperamid (ili
narkotici) u aktivnoj C. difficile infekciji treba striktno
izbegavati, jer korišćenje tih sredstava može rezultovatii teškom
ili komplikovanom formom kolitisa.
Svu antibiotsku terapiju koja nije neophodna treba ukinuti, a ako su
antibiotici iz bilo kog razloga ipak potrebni, treba koristiti
ciljane antibiotike uskog spektra. U bolesnika s teškim prolivom i
rizičnim faktorima za KDI, kao što su visoka starosna dob,
pretho-dno korišćenje antibiotika ili nedavne ho-spitalizacije, može
biti razumno empirijski uvesti antibiotsku terapiju za KDI, dok
rezultati ispitivanja stolice ne budu gotovi.
Mere za kontrolu infekcije koje preduzima zdravstveno osoblje
uključuju strogu izolaciju bolesnika uz korišćenje rukavica i
zaštitnih odela, pranje ruku sapunom i vodom, kao i korišćenje
agenasa za dezinfekciju prostorija na bazi ipohlorita. [24]
Metronidazol i vankomicin
Metronidazol je jeftin i efikasan preparat, koji se preporučuje za
lečenje blage do umerene KDI. U lečenju blagih do umerenih formi
bolesti ima sličnu efikasnost kao i vanko-micin. Uobičajena doza je
500 mg tri puta dnevno 10-14 dana. [2,6] U poslednje vreme se
pojavljuju radovi koji pokazuju da je metro-nidazol u lečenju KDI
manje efikasan nego u prošlosti. Tako je u Kanadi primećeno da je
stopa neuspešne terapije metronidazolom u pe-riodu od 1991. do 2002.
godine bila 9,6%. Me-đutim, u periodu 2003.-2004. g. ta stopa je
pora-sla na gotovo 26%. [1,2] Slično zapažanje je objavljeno u
Hjustonu gde je 22% bolesnika imalo simptome KDI i posle 10-to
dnevne ili čak i duže terapije metronidazolom. Osim toga, loš
odgovor na terapiju metronidazolom je povezan sa povećanom smrtnošću
od KDI [1,6]. Međutim, u ovom trenutku, ne postoje poznati
predviđajući faktori koji određuju u kojih pacijenata će terapija
metronidazolom biti efikasna. Metronidazol može biti povezan sa više
komplikacija nego vanko-micin. Nuzefekti metronidazola uključuju
mučninu, reakciju prilikom konzumiranja alkoholnih pića (sličnu
disulfuramu), meta-lni ukus, pečenje u jednjaku i perifernu
neuro-patiju. Ovaj lek se ne preporučuje za primenu kod dece ili kod
žena u periodu trudnoće i laktacije [3]. Oralni vankomicin je FDA
odobrila za lečenje KDI, ali je on znatno skuplji od metronidazola.
Vankomicin je bio superiorniji od metronidazola u bolesnika s teškom
KDI (stopa izlečenja od 97% za vankomicin i 76% za metronidazol).
Prime-ćeno je, pored toga, da stopa recidiva nije bila bitno
različita kod primene bilo kojeg od ova dva antibiotika [21]. Zbog
toga što se oralno unet vankomicin slabo apsorbuje, visoka
koncentracija antibiotika u stolici se postiže bez pojave sistemskih
nuspojava. Preporučena doza je 125 mg četiri puta dnevno tokom 10 do
14 dana. U bolesnika s teškom-komplikovanom KDI, preporučuje se
lečenje intravenskim metronidazolom uz dodavanje visoke doze
vankomicina (250 do 500 mg četiri puta dnevno) oralno ili putem
nazogastrične sonde (npr. kod onih sa ileusom) i/ili vankomicin u
vidu klizme [6].
Kod pacijenata koji promptno ne odgovore na oralnu terapiju
vankomicinom treba preispi-tati dijagnozu i tražiti druge uzroke
proliva ili druge načine lečenja (uključujući i hirurški tretman),
jer neuspeh vankomicin terapije kod KDI predstavlja neuobičajenu
pojavu.
Međutim, zbog visokih troškova lečenja oral-nim vankomicinom i
mogućnosti pojave rezi-stencije na taj antibiotik, a na osnovu
studija koje su pokazale sličnu uspešnost metro-nidazola i
vankomicina u blagim i umerenim formama KDI metronidazol se
preporučuje kao prva linija terapije u bolesnika sa prvom ili prvom
rekurentnom epizodom KDI blage do umerene forme bolesti, ukoliko ne
postoje kontraindikacije za njegovu primenu. [6,21] U bolesnika sa
KDI u kojih se stanje ne poboljša u roku od 72 do 96 sati treba
tražiti druge uzroke proliva. Ako su druge bolest isključene,
pacijenta treba prevesti sa terapije metroni-dazolom na terapiju
vancomicinom. [6] U slučaju da bolesnik ne podnosi metronidazol ili
dođe do pogoršanja proliva dok prima metronidazol, treba preći na
terapiju vanko-micinom. U bolesnika s teškim oblikom bolesti
(leukocitoza i/ili popuštanje bubre-ga) kao i kod pacijenata koji
imaju drugu ili dodatnu epizodu recidiva KDI vankomicin predstavlja
lek izbora.
Fidaksomicin
Fidaksomicin je makrociklični antibiotik uskog spektra delovanja
protiv gram-poziti-vnih aerobnih i anaerobnih bakterija,
uklju-čujući C. difficile. Fidaksomicin deluje loka-lno u crevima
jer ima malu, praktično bezna-čajnu sistemsku apsorpciju nakon
oralne pri-mene. Deluje baktericidno tako što inhibira sintezu
bakterijske RNK. Fidaksomicin spre-čava nastajanje spora C.
difficile in vitro. U in vitro studijama, fidaksomicin je protiv C.
difficile bio aktivniji od vankomicina [1,2]. U kliničkom
ispitivanju, posle desetodnevne te-rapije odgovor na terapiju
fidaksomicin-om (200 mg dva puta dnevno) bio je sličan terapiji sa
vankomicinom (125 mg četiri puta dnevno) (88,2% fidaksomicin prema
85,8% vanko-micin). Međutim, znatno manje pacijenata u grupi sa
fidaksomicinom je imalo recidiv bolesti (15,4% prema 25,3%) [2,25] U
analizi podgrupa ove studije pokazalo se je da su stope recidiva
bile značajno niže na terapiji fidaksomicin nego vankomicin u
bolesnika sa ne-hipervirulentnim sojem C. difficile (7,8% prema
25,5%), ali nisu primećene značajne razlike u pojavi recidiva kod
bolesnika zara-ženih hipervirulentnim sojem C. difficile (24,4%
prema 23,6%). Prijavljene nuspojave uglavnom su bile retke i slične
onima sa oralnim vankomicinom. Naknadna analiza podataka je pokazala
da i kada su bolesnici sa KDI morali da primaju druge antibiotike,
stopa izlečenja je bila znatno viša za fi-daksomicin u poređenju sa
vankomicinom (90% prema 79,4%). Osim toga u ovoj grupi stope
recidiva bile su niže pri korišćenju fidaksomicin u odnosu na
vankomicin (16,9% prema 29,2%) [14]. Dakle, ovi podaci pokazuju da
se fidaksomicin dobro podnosi, da ne zaostaje za oralnim
vankomicinom u lečenju blagih i umerenih formi KDI i da je terapija
fidaksomicinom povezana sa nižom stopom recidiva u odnosu na
vankomicin kod bole-snika zaraženih ne-hipervirulentnim sojem C.
difficile. Fidaksomicin ima primat nad ora-lnim vankomicinom posebno
kod onih bole-snika koji zahtevaju dodatnu terapiju antibi-oticima a
istovremeno imaju i KDI. FDA je odobrila fidaksomicin za lečenje
KDI. Međutim, nedostaju randomizovane studije koje upoređuju
fidaksomicin sa metronidazolom za lečenje prve epizode blage do
umerene KDI, gde metronidazol i dalje ostaje početna terapija
izbora. Osim toga, nije do kraja ispitana efi-kasnost fidaksomicin u
rekurentnoj KDI i u posebnim populacijama uključujući decu ili
pojedince sa zapaljenjskim bolestima creva.
Farmakoekonomska analiza korišćenja fidaks-omicina pokazuje da je
desetodnevna terapija fidaksomicinom 125 puta skuplja od terapije
metronidazolom i 4 puta skuplja od terapije vankomicinom. [1,26].
(Prosečna veleprodajna cena u SAD za fidaksomicin je 135,00 dolara
za svaku 200-mg dozu, 31,81 dolara za 125-mg kapsule oralnog
vancomcina i 0,72 dolara za 500-mg dozu metronidazola). Da bi
smanjile troškove, neke zdravstvene institucije (čak i u SAD) oralno
koriste ampule vankomicina pripremljene za intravenoznu aplikaciju
umesto kapsula oralnog vankomicina [1].
Uzimajući u obzir troškove lečenja, fidakso-micin je uglavnom
ograničen na korišćenje u bolesnika sa početnom epizodom KDI koji
imaju visoki rizik od recidiva (npr. pojedinci u poodmakloj životnoj
dobi, pacijenti s te-škom KDI, i oni koji primaju istovremeno
antibiotsku terapiju), a koji su zaražene ne-hipervirulentnim sojem
ili u onih koji su imali više recidiva. [26] Međutim, trenutno ne
postoje ozbiljni, primenjivi klinički kriterijumi kojima je moguće
predvideti pojavu recidiva KDI. Treba napomenuti da efika-snost
fidaksomicina u poređenju sa vankomi-cinom ili metronidazolom nije
dovoljno ispitivana. Fidaksomicin se, takođe, koristi u bolesnika
koji imaju ozbiljnu nepodno-šljivost ili alergijsku reakciju na
oralni vankomicin.
Fekalna mikrobna transplantacija
Glavni faktor rizika za KDI je sistemska upotreba antibiotika, koji
remete normalnu crevnu floru i dovode do povećane sklonosti za rast
C. difficile. Rizik od recidiva KDI nakon prvog tretmana je oko 20%
do 25% [2]. Ovaj rizik se dalje povećava sa ponovnim kori-šćenjem
sistemskih antibiotika i sa pona-vljanjem recidiva KDI [26].
Patofiziološke karakteristike rekurentne KDI nisu do kraja
razjašnjene, ali svakako uključuju poremećaj normalne fekalne flore
i neadekvatan imunološki odgovor domaćina na taj poremećaj.
Standardni tretman KDI pomoću antibiotika, kao što su metronidazol i
vankomicin dodatno narušava mikrobni sadr-žaj kolona, što pogoduje
širenju populacije C. difficile. Poznato je da su spore C. difficile
otporne na antibiotike.Stoga one mogu klijati do vegetativnih oblika
i posle ukidanja anti-biotske terapije. Ove činjenice mogu objasniti
ponavljanje KDI nakon prekida terapije, kao i visoku stopu
recidiviranja bolesti. Iako je postojala nada da će se pronalaskom
anti-biotoka uskog spektra poput fidaksomicina omogućiti brza obnova
crevnih mikroba u bolesnika s hroničnom rekurentnom formom KDI, ova
pretpostavka do sada nije dovoljno potkrepljena.
Smisao i cilj „bakterioterapije“ ili fekalne mikrobne
transplantacije (FMT) je restitu-isati normalnu crevnu floru uz
korišćenje crevnih mikroorganizama iz zdravog donora (putem tečne
suspenzije stolice), to jest vrati-ti normalne crevne mikrobe u
bolesnika sa rekurentnom KDI. Fekalna mikrobna transpla-ntacija se
proučava kao alternativa standar-dnoj antibiotskoj terapiji u
lečenje ponavlja-jućih formi KDI.
Metaanaliza 27 studija i prikaza slučajeva koja je uključila 317
bolesnika sa recidivirajućom KDI koji su lečeni FMT pokazala je
ukupnu stopu uspeha od 92%, s tim da je 89% bolesnika reagovalo već
posle prvog tretmana. U tim istraživanjima, 35% pacijenata primilo
je FMT putem klistira sa pozitivnim odgovorom od 95%, 23% bolesnika
preko nazogastrične sonde sa terapeutskim odgovorom od 76%, a 19%
putem kolonoskopije, sa stopom odgovora od 89% [27]. Studija sa
univerziteta u Minesoti iznela je početno iskustvo s FMT u 43
bolesnika sa recidivom KDI uključujući i bolesnike s hroničnim
zapaljenjskim bolestima creva. Ovi bolesnici su primili FMT putem
kolonoskopije bilo od pojedinačnih osoba poznatih donora ili iz
standardne baze donora. Ukupna stopa izlečenja infekcije bila je 86%
u odgovoru na jednu ubrizganu suspenziju. Nije bilo razlike u
rezultatima u odnosu na donorski izvor, a nisu zabeležene bilo kakve
ozbiljne nuspojave [2,27] Još jedna skorašnja studija iznela je
iskustvo s FMT putem kolonoskopije u 70 bolesnika sa rekurentnom
KDI. Tokom 12-to nedeljnog praćenja, FMT je dovela do povlačenja
bolesti u svih bolesnika s ne-hipervirulentnim sojem C. difficile i
89% onih s hipervirulentnim sojem. Nije bilo komplikacije koje bi se
mogle pripisati FMT. [27] Još jedna grupa istraživača (iz San
Franciska) iznela je svoje iskustvo sa FMT preko klistira. I oni su
pronašali sličnu stopu terapeutskog odgovora bez neželjenih događaja
od same FMT. [28] Još nema studija koje pokazuju značaj FMT za
profilaksu u bolesnika sa visokim rizikom recidiva nakon prve
epizode KDI i nije bilo poređenja FMT sa konvencionalnim tretmanima
za KDI.
Noviji rad iz Kanade prikazuje lečenje sa super prečišćenim
bakterijskim sadržajem stolice ("super-probiotik") koja zamenjuje
suspenziju stolice u klasičnoj FMT. Reč je o bakteri-jskom sadržaju
creva poraslom u posebnom uređaju koji imitira uslove u crevima
(“Robo-gut”). Na taj način se ne infudira stolica donora već
izdvojeni bakterijski sadržaj iz velikog broja stolica.
Infundiranjem ovog ba-kterijskog izolata u desni kolon putem
kolo-noskopije dobijeni su dobri rezultati u lečenju recivirajućih
formi KDI. [31]
Dosadašnje nekontrolisane studije sugerišu da FMT može biti opcija
kod bolesnika sa više epizoda KDI u cilju sprečavanja novih
recidiva. Ipak potrebne su šire sveobu-vatnije studije koje će
potkrepiti dosadašnje izveštaje i uporediti FMT sa drugim meto-dama
lečenja recidiva KDI. U toku su studije koje sagledavaju FMT u
odnosu na izbor donora, upoređujući korišćenje standardne baze
dona-tora u odnosu na pojedinačne donatore. Neop-hodna je provera
donora na prenosive zarazne bolesti, standardizacija pripremnih
tehnika, procena dugoročne sigurnosti i efiksnosti FMT. [29,30]
Druge opcije za lečenje KDI
Dodatne potencijalne opcije za lečenje KDI uključuju rifaksimin,
nitazoksanid, holesti-ramin, intravenozni imunoglobulin (IVIG),
monoklonska antitela, vakcine i probiotike.
Rifaksimin je gastrointestinalni-selektivni antibiotik koji se
odlikuje širokim anti-mikrobnim spektrom. Efikasan je protiv ve-ćine
gram-negativnih i gram-pozitivnih bakte-rija (i aerobnih i
anaerobnih) i ima odličan in vitro učinak na C. difficile [1,32].
Iako ima široki antibiotski spektar, rifaksimin ne uzrokuje značajne
promene u crevnoj flori. Međutim, postoji bojazan da će se širokom
pri-menom razviti rezistencija C. difficile i drugih crevnim mikroba
na ovaj antibiotik. Rifa-ksimin se pokazao efikasnim u lečenju KDI u
manjim kliničkim studijama i prikazima slučajeva [1]. Nedavna
randomizovana kontro-lisana studija je pokazala da je uspešnost
rifaksimina bila slična efikasnosti vanko-micina (57% prema 64%) .
Nije bio inferioran u odnosu na vankomicin u rezoluciji proliva (80%
prema 81%) i recidiva (9% prema 14%) [32]. Ovi podaci sugerišu da
rifaksimin može biti alternativa vankomicinu za lečenje KDI.
Rifaksimin se trenutno ne preporučuje kao monoterapija za KDI, ali
se može koristiti za rekurentne KDI nakon lečenja oralnim
vanko-micinom (125 mg četiri puta dnevno u toku 14 dana) ili u formi
"rifaksimin gonič" (“rifaksimin chaser”) (400 mg oralno dva puta
dnevno za 14 dana) [1,33].
Nitazoksanid je antiparazitarni lek koji je aktivan i protiv C.
difficile i efikasan kao i vankomicin i metronidazol za lečenje KDI
[33,34]. Međutim, nitazoksanid nema jasne prednosti u odnosu na
druge dostupne lekove, nedostaju i podaci o dugoročnoj sigurnosti i
delotvornosti. Trenutno, nitazoksanid se može smatrati alternativnom
terapijom u bolesnika sa više epizoda recidiva koje su se
pojavljiale uprkos terapiji vankomicinom i metroni-dazolom, a koji
nisu kandidati za FMT ili druge terapije.
Anjonske izmenjivačke smole poput hole-stiramina deluju tako da
vezuju toksine i mogu pomoći da se smanje i ublaže simptomi
bo-lesti. Međutim, ne postoje dokazi da dodavanje holestiramina
smanjuje rizik od recidiva. Sa druge starne, ove smole takođe vežu
vankomicin i smanjuju negovu efikasnost, tako da ga ne treba
koristiti istovremeno sa vankomicinom [6,35]. Ukratko, uloga
anjonskih smola u lečenju KDI je nejasna i nedorečena.
Intravenski imunoglobulini su korišćeni za lečenje rekurentne i
teške KDI sa promen-ljivim uspehom. Ne postoje randomizovanene
kontrolisane studije koje pokazuju ubedljivu korist od IVIG terapije
u KDI. Intravenski imunoglobulini sadrže antitela protiv C.
difficile toksina A i B, i mogu biti korisna opcija u smanjenju
rizika od ponavljanja bolesti u bolesnika u kojih druge terapije
nisu uspele ili kao adjuvantna terapija u ozbiljno bole-snih
pacijenata sa fulminantnom KDI [36].
U velikoj, kontrolisanoj studiji u lečenju KDI monoklonskim
antitelima protiv C. difficile toksina A i B uz antibiotsku
terapiju, stopa recidiva KDI je bila niža u bolesnika koji su lečeni
i monoklonskim antitelima u odnosu na one lečene samo antibiotikom
(7% prema 25%). Stopa recidiva u bolesnika sa hipervi-rulentnim
sojem C. difficile je bila 8% u grupi lečenih antitelima i 32% u
placebo grupi. U bolesnika sa rekurentnom KDI, druga epizoda
recidiva dogodila u 7% u grupi lečenih antitelima i 38% u placebo
grupi [37]. Dakle, lečenje monoklonskim antitelima može imati ulogu
dodatnog lečenju u bolesnika sa više epizoda recidiva ili u onih sa
fulminantnom formom KDI.
Preliminarni pokušaji parenteralne vakcine koja sadrži toksoid A i B
pokazuju odličan porast antitela u serumu zdravih odraslih
ispitanika. Prikazan je slučaj tri bolesnika koji su bili na stalnoj
terapiji vankomicinom zbog uporne rekurentne KDI. Sva trojica su
bila u situaciji da mogu prekinuti terapiju vankomicinom, a dva
bolesnika su imala značajno povećanje koncentracije serumskih
antitela za toksin A i B. [37] U drugoj studiji mlađi odraslih i
stariji volonteri su primili tri različite doze C. difficile toksoid
vakcine ili placebo. Postignuta je 100% stopa seroko-nverzije u
mlađih volontera sa svim dozama toksina i varijabilni odgovor
zavisan od doze u starijih ispitanika [38] Uzgred, stopa
sero-konverzie za toksin B je bila niža nego za toksin A u obe dobne
grupe. Tokom studije nisu registrovane značajne nuspojave.U toku je
ispitivanje koje treba da proceni efikasnost vakcine za prevenciju
recidiva KDI.
Probiotici su pripremljeni, živi mikroor-ganizmi koji se unose u
digestivni trakt pacijenta sa namerom da se razmnože u mikro-flori
kolona, radi sprečavanja pojave KDI, odnosno lečenja postojeće
infekcije. Od mno-gih probiotika najčešće se koriste vrste
Lactobacillus, Bifidobacterium i Saccharomyces. Trenutno se
probiotici ne koriste u primarnoj prevenciji od KDI zbog ograničenih
podataka i potencijalnog rizika od infekcije krvi tim agensima
[6,39]. Saccharomyces boulardii proi-zvodi enzim koji inhibira
delovanje C. difficile toksina A i B. Saccharomyces boulardii je
ispi-tivan u kombinaciji sa antibiotikom u lečenju KDI. Studije su
pokazale smanjen rizik od od recidiva KDI ako je Saccharomyces
boulardii korišćen zajedno sa antibiotikom. Iako mnoge studije
nagoveštavaju korisnost probiotika, zbog nedostatka velikih
randomizovanih kon-trolisanih istraživanja ovi agensi se trenutno ne
preporučuju kao etablirana terapija u vodičima dobre prakse [1,6]
Hirurško lečenje KDI
Hirurški tretman u lečenju KDI je indikovan kod pacijenata koji ne
reaguju na medika-mentoznu terapiju u slučajevima fulminantnog
kolitisa. Ova komplikacija je relativno retka i karakteriše se
teškim opštim stanjem, sistemskom infekcijom, intenzivnim bolovima u
trbuhu i distenzijom kolona na radiogramu. U ovom slučaju proliv
može biti odsutan zbog ileusa. Tradicionalni hirurški pristup KDI je
subtotalna ili totalna kolektomija. Ova intervencija je često
povezana sa lošim ishodom - smrtnošću i do 50% [40] Faktori koji
nagoveštavaju verovatnost povećane smrt-nosti nakon kolektomijom u
lečenju fulmi-nantnog KDI su stariji od 65 godina, insu-ficijencija
bubrega, leukocitoza, povećan nivo laktata u serumu,
hipoalbuminemija, sepsa, insuficijencija više organa i
imunosupre-sija. [40] Vreme hirurške konsultacija za teške forme KDI
ostaje otvoreno, između ostalog i stoga što su hirurški pacijenti sa
lošim opštim stanjem ustvari i loši kandi-dati za operaciju zbog
starosti i pridruženih komorbiditeta. Međutim, odlaganje operacije u
ranoj fazi fulminantnog kolitisa dovodi do povećanja broja
negativnih ishoda, uključujući i smrt. Stoga se preporučuje da se
hirurška konsultacija obavi ranije ukoliko se proliv pogoršava
uprkos intenziviranju medika-mentozne terapije, odnosno čim se
primete prvi znaci sepse ili megakolona. [41]
Lečenje recidivirajuće KDI
Glavni problem u vođenju KDI jesu recidivi koji se javljaju u 20% do
25% bolesnika nakon prve epizode KDI. [2,6] Faktori rizika za
nastanak rekurentne KDI prikazani su na tabeli 3.
Klinički, rekurentna KDI je definisana kao pojava simptomatskih
proliva ili bolova u trbuhu, sa pozitivnim rezultatima testa
stoli-ce unutar 56 dana od prethodne epizode KDI, a nakon
privremenog povlačenja simptoma [6]. Epizode koje se dogode nakon 56
dana od prethodne infekcije su verovatno reinfekcije, međutim, da
bismo razlikovali novu infekciju od reinfekcije, potrebno je uraditi
genotipske analize uzoraka stolice. Ova definicija je važna, jer
pozitivne rezultate ispitivanja stolice bez proliva ne treba
smatrati pona-vljanjem KDI. U ovom slučaju se može raditi o
kliconoštvu. Rekurentni prolivi sa norma-lnim nalazima testova
stolice treba da upute kliničara na šire
diferencijalno-dijagno-stičko razmišljanje u smislu inflamatornih
bolesti creva, iako postoji mogućnost lažno-negativnih rezultata
testiranja stolica u bolesnika sa pravom epizodom rekurentne KDI. U
bolesnika s teškim simptomima koji upućuju na recidiv, lečenje se
može započeti još dok se čekaju rezultati pregleda stolice. [19]
Nema većih randomizovanih kontrolisanih ispitivanja bolesnika sa
višestrukim recidi-vima KDI, a mogućnosti lečenja i preporuke su
često izgrađene na osnovu nalaza malih studija i prikaza slučajeva.
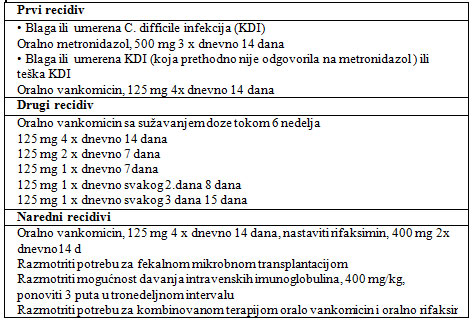
U bolesnika sa potvrđenim prvim recidivom, početna terapija bi
trebalo da bude dvone-deljno lečenje oralno primenjenim
metroni-dazolom za blage do umerene KDI (ako je prva infekcija
odgovorila na ovaj lek) ili oralni vankomicin za teške forme KDI.
Za drugi recidiv preporučuje se 6-7 nedelja terapija oralnim
vankomicinom sa režimom sukcesivnog smanjivanja („sužavanja“) doza
[2,6] (videti Tabelu 4).
Tabela 3 Faktori rizika za rekurentnu

Za naredne recidive preporučuje se 10 - 14 dana standardne doze
oralnog vankomicina, čemu sledi 14-dnevno terapija rifaksimina
oralno (400 mg dva puta dnevno). U ovoj fazi, može se razmatrati i
oralna primena fidaksomicina ili fekalne mikrobne transplantacije,
iako fidaksomicin nije studiozno obrađivan u bolesnika sa više
ponavljajućih epizoda KDI. Dodatne mogućnosti lečenja za više
recidiva uključuju 400 mg/kg IVIG, ponoviti do tri puta, ako je
potrebno, ili kombinovane terapije s oralnim vankomicinom i
rifaksiminom. U nekih bolesnika, dugotrajno lečenje oralnim
vankomicinom (125 mg dnevno ili svaki drugi dan) može biti potrebno
za kontrolu simptoma i sprečavanje epizoda recidiva (videti Tabelu
4).
Tabela 4. Lečenje rekurentne C. difficile
infekcije rifaksimin
ZAKLJUČAK
Učestalost i ozbiljnost KDI su u porastu. KDI se sve češće
opisuje u osoba za koje se ranije mislilo da imaju mali rizik za
nastanak infekcije. Identifikovani su novi faktori rizika za
nastanak KDI. Ponavljanje KDI je i dalje glavni izazov u tretmanu
bolesnika sa ovom infekcijom. Pojava novijih terapija, uključujući
fidaksomicin i fekalnu mikrobnu transplantaciju predstavlja dodatne
opcije u vođenju KDI. Dodatna istraživanja se usmera-vaju na
pronalaženje novih mogućnosti lečenja KDI, uključujući nove
antibiotike, monoklon-ska antitela, vakcine i probiotike.
LITERATURA
- Khanna S, Pardi DS. Clostridium difficile infection: new
insights into management. Mayo Clin Proc 2012; 87(11):1106-17.
- Khanna S, Pardi DS, Aronson SL et al. The epidemiology of
community-acquired Clostridium difficile infection: a
population-based study. Am J Gastroenterol. 2012; 107(1):150.
[published correction in] 2011;107(1):89–95.
- Pépin J, Valiquette L, Alary ME et al. Clostridium
difficile-associated diarrhea in a region of Quebec from 1991 to
2003: a changing pattern of disease severity. CMAJ 2004;
171(5):466–472.
- Rupnik M, Kotnik Kevorkijan B, Clostridium difficile: ali
postaja pogostejši tudi v Sloveniji? Uvodnik 108 JAMA—SI, junij
2009, letnik 17, št. 3.
- Opavski N. Mikrobiološka dijagnostika infekcija izazavanih
Clostridium difficile. Medicinska istraživanja 2011; 45( 5):
45-46.
- Cohen SH, Gerding DN, Johnson S et al. Society for
Healthcare Epidemiology of America; Infectious Diseases Society
of America. Clinical practice guidelines for Clostridium
difficile infection in adults: 2010 update by the Society for
Healthcare Epidemiology of America (SHEA) and the Infectious
Diseases Society of America (IDSA). Infect Control Hosp
Epidemiol 2010; 31(5):431–455.
- Khanna S, Pardi DS, Aronson SL, Kammer PP, Baddour LM.
Outcomes in community-acquired Clostridium difficile infection.
Aliment Pharmacol Ther 2012; 35(5):613–618.
- Enoch DA, Butler MJ, Pai S, Aliyu SH, Karas JA. Clostridium
difficile in children: colonisation and disease. J Infect 2011;
63(2):105–113.
- Otten AM, Reid-Smith RJ, Fazil A, Weese JS. Disease
transmission model for community-associated Clostridium
difficile infection . Epidemiol Infect 2010; 138(6):907–914.
- Merrigan M, Venugopal A, Mallozzi M et al. Human
hypervirulent Clostridium difficile strains exhibit increased
sporulation as well as robust toxin production . J Bacteriol
2010; 192(19):4904–4911.
- Kuijper EJ, Barbut F, Brazier JS et al. Update of
Clostridium difficile infection due to PCR ribotype 027 in
Europe, 2008. Euro Surveill 2008; 13(31): pii:18942.
- Shah K, Pass LA, Cox M, Lanham M, Arnold FW. Evaluating
contemporary antibiotics as a risk factor for Clostridium
difficile infection in surgical trauma patients. J Trauma Acute
Care Surg 2012; 72(3):691–695.
- Rea MC, O'Sullivan O, Shanahan F et al. Clostridium
difficile carriage in elderly subjects and associated changes in
the intestinal microbiota. J Clin Microbiol 2012; 50(3):867–875.
- Mullane KM, Miller MA, Weiss K et al. Efficacy of
fidaksomicin versus vankomicin as therapy for Clostridium
difficile infection in individuals taking concomitant
antibiotics for other concurrent infections [published
correction appears in Clin Infect Dis. 2011; 53(12):1312. Dosage
error in article text]. Clin Infect Dis 2011; 53(5):440–447.
- Dubberke ER, Gerding DN, Classen D et al. Strategies to
prevent Clostridium difficile infections in acute care
hospitals. Infect Control Hosp Epidemiol 2008; 29 Suppl 1:81–92.
- Khanna S, Pardi DS. IBD: Poor outcomes after Clostridium
difficile infection in IBD. Nat Rev Gastroenterol Hepatol 2012;
9(6):307–308.
- Linsky A, Gupta K, Lawler EV, Fonda JR, Hermos JA. Proton
pump inhibitors and risk for recurrent Clostridium difficile
infection [published correction appears in Arch Intern Med 2010;
170(13):1100] . Arch Intern Med 2010; 170(9):772–778.
- Khanna S, Aronson SL, Kammer PP, Baddour LM, Pardi DS.
Gastric acid suppression and outcomes in Clostridium difficile
infection: a population-based study. Mayo Clin Proc 2012;
87(7):636–642.
- Kufelnicka AM, Kirn TJ. Effective utilization of evolving
methods for the laboratory diagnosis of Clostridium difficile
infection. Clin Infect Dis 2011; 52(12):1451–1457.
- Peterson LR, Mehta MS, Patel PA et al. Laboratory testing
for Clostridium difficile infection: light at the end of the
tunnel. Am J Clin Pathol 2011; 136(3):372–380.
- Zar FA, Bakkanagari SR, Moorthi KM, Davis MB. A comparison
of vankomicin and metronidazole for the treatment of Clostridium
difficile-associated diarrhea, stratified by disease severity.
Clin Infect Dis 2007; 45(3):302–307.
- Keddis MT, Khanna S, Noheria A, Badour LM, Pardi DS, Qian Q.
Clostridium difficile infection in patients with chronic kidney
disease. Mayo Clin Proc 2012; [In Press]
- Shivashankar R, Khanna S, Kammer PP et al. Clinical
predictors of severe complicated Clostridium difficile
infection. Am J Gastroenterol 2011; 106(S2):S162.
- Stojanović P, Kocić B i sar. Terapija oboljenja izazvanih
clostridium difficile Acta Medica Medianae 2007; 46(2):31-36.
- Cornely OA, Crook DW, Esposito R et al. OPT-80-004 Clinical
Study Group [Collaborators (82)] Fidaksomicin versus vankomicin
for infection with Clostridium difficile in Europe, Canada, and
the USA: a double-blind, non-inferiority, randomised controlled
trial. Lancet Infect Dis 2012; 12(4):281–289.
- Hu MY, Katchar K, Kyne L et al. Prospective derivation and
validation of a clinical prediction rule for recurrent
Clostridium difficile infection. Gastroenterology 2009;
136(4):1206–1214.
- Mattila E, Uusitalo-Seppälä R, Wuorela M et al. Fecal
transplantation, through colonoscopy, is effective therapy for
recurrent Clostridium difficile infection. Gastroenterology
2012; 142(3):490–496.
- Kassam Z, Hundal R, Marshall JK, Lee CH. Fecal transplant
via retention enema for refractory or recurrent Clostridium
difficile infection. Arch Intern Med 2012; 172(2):191–193.
- Bakken JS, Borody T, Brandt LJ et al. Fecal Microbiota
Transplantation Workgroup Treating Clostridium difficile
infection with fecal microbiota transplantation. Clin
Gastroenterol Hepatol 2011; 9(12):1044–1049.
- E. Schutze, Rodney E, Willoughby, Gordon Jr. Policy offers
recommendations on managing C. difficile infections in pediatric
patients. AAP News [serial on internet]. 2013; 34:1.pp1.
Available from:
http://aapnews.aappublications.org/content/34/1/1.2
- Petrof EO, Gloor GB, Vanner J, Weese SJ et al. Stool
substitute transplant therapy for the eradication of Clostridium
difficile infection: ‘RePOOPulating’ the gut. Microbiome 2013;
1:3. Available from:
http://www.microbiomejournal.com/content/1/1/3
- Pardi DS, Brennan R, Spinnell M et al. The efficacy and
safety of rifaksimin vs. vankomicin in the treatment of mild to
moderate C. difficile infection: a randomized double-blind
active comparator trial. Gastroenterology 2012; 142(5):S-599.
- Musher DM, Logan N, Bressler AM, Johnson DP, Rossignol JF.
Nitazoksanide versus vankomicin in Clostridium difficile
infection: a randomized, double-blind study. Clin Infect Dis
2009; 48(4):e41–e46.
- Musher DM, Logan N, Hamill RJ et al. Nitazoxanide for the
treatment of Clostridium difficile colitis [letter]. Clin Infect
Dis 2006; 43(4):421–427. Young JD, Mangino E, Stevenson KB,
Koletar SL. Nitazoxanide versus metronidazole for Clostridium
difficile - associated colitis [letter]. Clin Infect Dis 2007;
44(1):152; author reply 152-154.
- Taylor NS, Bartlett JG. Binding of Clostridium difficile
cytotoxin and vankomicin by anion-exchange resins. J Infect Dis
1980; 141(1):92–97.
- Abougergi MS, Kwon JH. Intravenous immunoglobulin for the
treatment of Clostridium difficile infection: a review. Dig Dis
Sci 2011; 56(1):19–26.
- Lowy I, Molrine DC, Leav BA et al. Treatment with monoclonal
antibodies against Clostridium difficile toxins. N Engl J Med
2010; 362(3):197–205.
- Greenberg RN, Marbury TC, Foglia G, Warny M. Phase I dose
finding studies of an adjuvanted Clostridium difficile toxoid
vaccine. Vaccine 2012; 30(13):2245–2249.
- Dendukuri N, Costa V, McGregor M, Brophy JM. Probiotic
therapy for the prevention and treatment of Clostridium
difficile-associated diarrhea: a systematic review [published
correction appears in CMAJ. 2005; 173(4):345]. CMAJ 2005;
173(2):167–170.
- Markelov A, Livert D, Kohli H. Predictors of fatal outcome
after colectomy for fulminant Clostridium difficile colitis: a
10-year experience. Am Surg 2011; 77(8):977–980.
- Seder CW, Villalba MR, Robbins J et al. Early colectomy may
be associated with improved survival in fulminant Clostridium
difficile colitis: an 8-year experience. Am J Surg 2009;
197(3):302–307.
|
|
|
|




